 2195
2019-08-26
2195
2019-08-26
温度,光照,电磁场或pH响应性的材料可用作控释剂,响应涂层,形状记忆材料以及传感器。而由于生物系统的多样性,生物响应性材料(如病原体)需要更强的靶向性和多样性设计。得益于DNA的高特异性,基于DNA的响应性材料已被广泛应用于生物传感,药物释放以及基因治疗。但目前,基于DNA的水凝胶体系设计复杂,对外部刺激的快速识别和响应通常需要高浓度的触发信号,限制其在生物传感和诊断的应用中。
近期,美国麻省理工学院James J. Collins及其研究小组报道了一种可批量应用的,可编程的CRISPR响应智能材料。CRISPR 英文全称是 Clustered Regularly Interspaced Short Palindromic Repeats,规律成簇的间隔短回文重复,是大多数细菌及古细菌中一种不断进化适应的免疫防御机制。CRISPR系统由DNA核酸酶(Cas12a)和向导RNA(gRNA)组成。gRNA识别出外源DNA,碱基配对成功后,Cas12a将DNA双螺旋结构切断。这与真核生物中RNA干扰(RNAi)的原理是相似的。作者将CRISPR技术创造性地整合到DNA水凝胶中,Cas12a-gRNA可以特异性识别外源DNA,激活Cas12a以切割目标DNA以及不加区分的单链DNA (ssDNA)。
DNA水凝胶解体,实现对目标DNA的响应,可用于多种药物、纳米颗粒甚至细胞的可控释放。该水凝胶结构可以响应任何目标DNA序列而无需重新设计不同的水凝胶体系。另外由于CRISPR-Cas12a系统高效的切割,该水凝胶体系无需高浓度目标物触发。该体系巧妙地将生物信息转换成宏观材料的性能的变化,可有效应用于法医学分析,医学诊断以及环境监测。作者分别报道了小分子药物或者蛋白质可控释放的多臂聚乙二醇水凝胶,金纳米颗粒甚至活细胞可控释放的聚丙烯酰胺水凝胶,用作保险丝的导电炭黑水凝胶以及与微流控芯片结合实现病毒的快速灵敏检测。

这项工作在《Science》一经发表、《Nature》同步报道。同时,谭蔚泓院士等在《Science》上发表评述:该体系可用作便携,快速和定量的生物传感器,用于检测危险病毒病原体的特定菌株,区分病原菌、人类DNA的基因型,体外鉴定无细胞肿瘤DNA突变等。DNA水凝胶与CRISPR-Cas系统结合将有利于提高基因编辑相关应用的精确性,高效性以及时空可控性。
图文速递
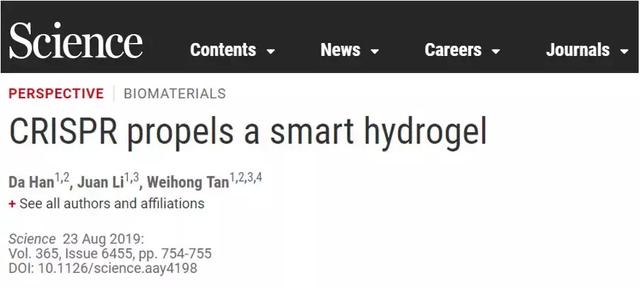
图1. Cas12a调节的小分子和酶可控释放PEG水凝胶。
(A)ssDNA作为可裂解的连接剂将有效负载附加到惰性PEG基质上。hv,光能。(B) 负载的荧光基团的释放仅由特异性的dsDNA触发,对打乱的dsDNA序列无响应性。(C)负载的功能性酶可被足量释放,利用HRP assay 在几分钟内可检测到酶活性。(D)Cas12a活化以及荧光团的释放(t=8 h)是由dsDNA序列和gRNA的互补识别控制的。(E)PEG水凝胶的交联密度影响负载物的释放效率。(F)相互匹配的寡核苷酸与ssDNA预杂交选择性地降低负载物的释放效率(观察时间:1.5h)。
图2. 可编程的、纳米颗粒和活细胞可控释放的PA-DNA水凝胶。

(A)ssDNA交联的DNA功能性的PA分子链。(B)Cas12调节PA-DNA水凝胶的降解。(C)25个gRNAs和dsDNA组合触发凝胶降解以及12小时后的信号对比。(D)AuNPs 从7% (w/v) PA-DNA凝胶内的释放,通过凝胶的光学密度变化来追踪AuNPs释放。(E)特异性序列识别引发的PA-DNA凝胶降解,实现非粘附型细胞PBMCs的释放。细胞在封装前分别用蓝色和红色celltracker 染色,ssDNA也被荧光染色以显示细胞的释放。
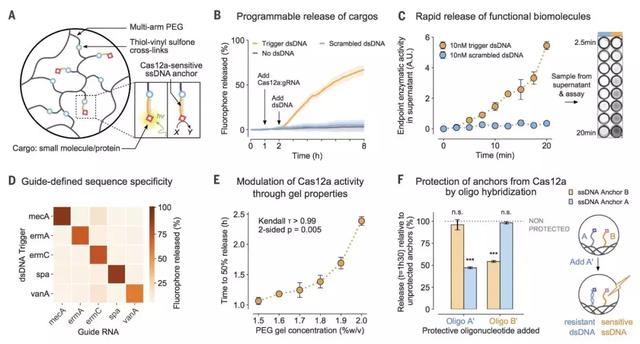
图3. CB-DNA水凝胶用作电气保险丝。
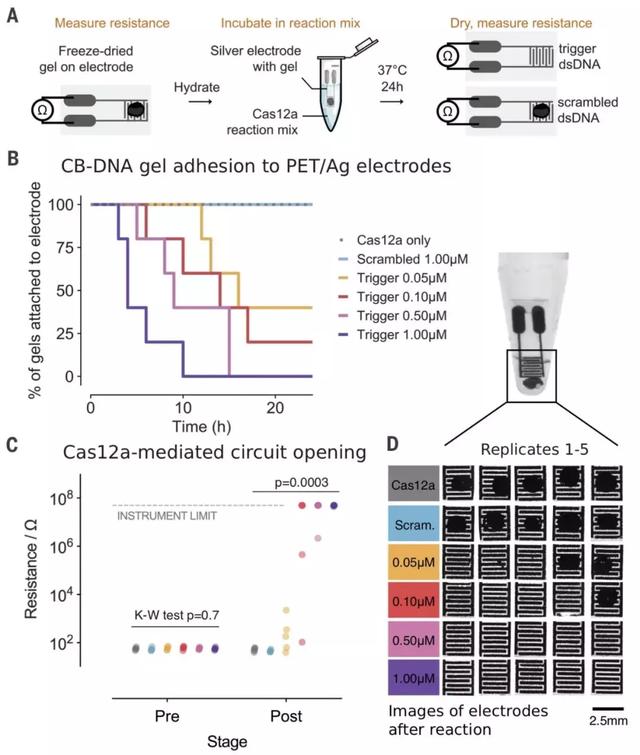
(A)实验工作流程图。(B)随着DNA触发浓度增加的CB-DNA凝胶的降解动力学(n = 5)。每隔一小时检查一次以记录凝胶从电极上的脱落。(C)图(B)中CB-DNA凝胶脱离后或者24小时后无脱离的交叉形电极之间的电阻。用Kruskal-Wallis (K-W) 测试(前:P = 0.7, 后: P = 0.0003)和POST-HOC测试(1.0mM and 0.5 mM:前all > 0.99,后P < 0.05,其他组P > 0.05)比较了反应前后的测量值。(D)在反应中脱离交叉形电极的凝胶的代表性图像(顶部)和图(B)中从反应中祛除的显微镜照片(底部)。
图4. Cas12a水凝胶前驱体的消化调节纸基微流体装置(mPAD)的渗透性,用于视觉和电子读数双诊断。
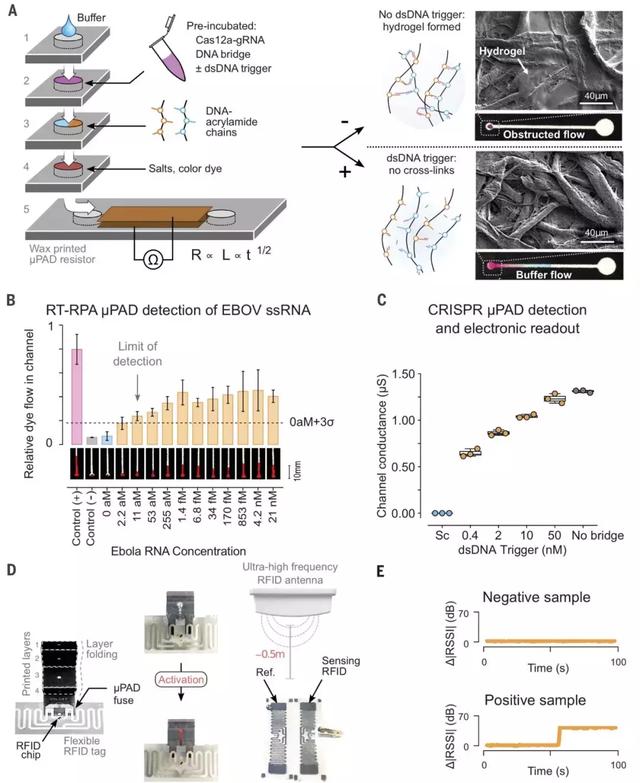
(A)可堆叠的μPAD设计改善以适用于CRISPR凝胶操作以及电子读数。层1至4包含亲水区域,其在折叠时形成连续通道并且进入层5中的侧向流动通道。作为缓冲排芯的作用,层5被导电层覆盖进行电导率测量。在靶向触发的情况下,Cas12a切断DNA连接,阻止通道中的水凝胶交联并实现流动。插图显示了通道(顶部)和没有交联水凝胶(底部)的SEM图像。(B)比色耦合的终点测量(t=5mins),RT-RPA mPAD水凝胶检测系统用于不同浓度的ssRNA埃博拉病毒(EBOV)输入(平均值±SD,n=3 mPADs)。显示了mPAD通道的代表性图像,阳性对照对应于在预孵育反应中没有ssDNA链的流动和阴性对照对应于未消化的ssDNA链的流动。在0和11-aM的ssRNA样本中差异值为P = 0.0057。(C)4小时的预消化步骤后,对于不同浓度的dsDNA和MRSA触发信号,测量了通道上的电阻的终点测量(5分钟)。Sc = 50 nM 打乱的dsDNA。(D)纸- 流体装置与RFID柔性标签的集成示意图。预消化步骤中的Cas12a激活导致环形RFID标签中的交叉型电极短路,标签间的绝对值差异说明dsDNA触发器激活了Cas12a。(E)在RFID mPAD装置的实验盲法试验中,正面和负面的代表性信号轨迹结果(图S29中的全套)。通过RT-RPA扩增含有0aM(阴性)或11 aM(阳性)EBOV ssRNA触发的样品。样品与ssDNA凝胶和Cas12a-gRNA孵育4小时,并在mPAD-RFID装置上测定。
文章链接:https://science.sciencemag.org/content/365/6455/780/tab-pdf
作者:毫无逻辑小Cu 来源:高分子科学前沿
上一篇: “光合天线”捕获“光能”
下一篇: 迄今为止最小发动机仅一个离子大
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。