 1771
2021-08-17
1771
2021-08-17
颗粒在线讯:近日,《美国化学会志》在线发表中国科学院生物物理研究所研究员柯莎研究组等的研究论文Conformational expansion of Tau in condensates promotes irreversible aggregation。该研究利用单分子荧光技术,揭示Tau蛋白发生液-液相分离过程中的构象动态变化及其与不可逆淀粉样聚集发生的相关分子机制。
生物大分子相变是近年来生物学领域新兴的研究热点,生物大分子通过液-液相分离可动态组装成无膜细胞器,执行多种重要生物学功能。大多数参与相分离的蛋白质均含有低复杂度区域或天然无序区域,它们的异常液-液相分离及液-固相转变可导致疾病发生。Tau蛋白作为一种无序蛋白,在正常生理状态下,具有结合微管并调控其组装成束和稳定性的功能。全长Tau蛋白包含N端结构域、脯氨酸富集结构域、含有四个不完整重复序列的微管结合结构域,以及C端结构域。Tau蛋白异常聚集形成纤维缠结被认为与多种神经退行性疾病发生密切相关。近年已有研究发现,Tau蛋白在不同条件下发生相分离的现象,并揭示Tau蛋白相分离能够促进微管蛋白成核和组装成束。然而,关于Tau蛋白在相分离过程中发生的结构域间构象变化,及其与不可逆淀粉样聚集发生的关系却尚未明确。
单分子荧光技术具有探测系综体系中大分子的亚组分分布及其动态转化的优势,是研究天然无序蛋白(intrinsically disordered proteins,IDP)构象与动态的有力工具。近年柯莎研究组以单分子荧光技术作为主要研究手段,开展一系列关于蛋白构象动态以及互作机制、蛋白质淀粉样聚集的分子机制的研究工作,促进了在单分子水平上理解蛋白质折叠、变构、组装动态机制及其与功能的关系。
该研究利用单分子FRET技术和荧光相关光谱技术(fluorescence correlation spectroscopy,FCS)研究了Tau蛋白相分离过程中的分子内构象变化及分子间互作。结果显示,Tau蛋白在相分离状态下,其N端和C端结构域打开,暴露出位于中间的微管结合区域。上述变化打破天然态Tau蛋白单体的“paperclip”稳定构象状态,促进了Tau蛋白分子间相互作用,使之在纳摩尔浓度下形成纳米尺度的寡聚体,临界浓度仅为10 nM。这些寡聚体作为核心促进高浓度下Tau蛋白液-液相变的发生。相变所导致的Tau蛋白结构域打开、构象伸展及分子间寡聚体形成,促进Tau蛋白发生以微管结合区域为核心的不可逆淀粉样纤维化,而与疾病相关的P301L和P301S突变体则可显著加速纤维化的进程。
该研究从单分子水平揭示了Tau蛋白发生相分离的机制,为深入理解蛋白质从天然态到功能性相分离态、以及进一步转化为病理聚集物的过程提供新线索。研究得到科技部、国家自然科学基金委等资助。
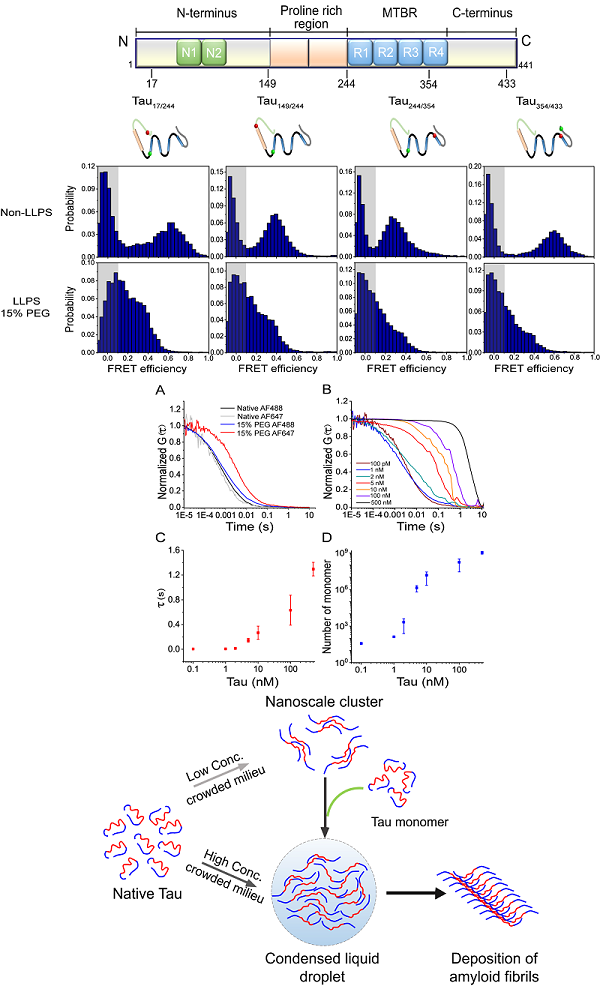
单分子FRET和FCS技术研究Tau蛋白在相分离状态下的构象变化及其与不可逆纤维化的关系
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。