 1342
2021-08-31
1342
2021-08-31
颗粒在线讯:近日,中国科学院国家纳米科学中心研究员陈春英课题组与高能物理研究所研究员赵丽娜,在石墨炔-胞内蛋白质互作与调控巨噬细胞表型的机制研究方面取得重要进展。相关研究成果以The Underlying Function and Structural Organization of the Intracellular Protein Corona on Graphdiyne Oxide Nanosheet for Local Immunomodulation为题,发表在Nano Letters上。该研究采用同位素标记等方法定量剖析氧化石墨炔与其胞内形成的蛋白冠中高度富集的信号传导与转录激活因子(STAT3)蛋白的相互作用,进而影响肿瘤相关巨噬细胞的表型,改善肿瘤微环境的免疫抑制。
肿瘤相关巨噬细胞(TAM)是多种肿瘤间质中数目较多的炎性细胞群,促进肿瘤的浸润、转移及复发,诱导免疫抑制,与实体瘤预后不良相关。针对肿瘤相关巨噬细胞主要有三种治疗方法:抑制巨噬细胞的招募、直接杀伤TAM及TAM重编程。基于多样的物理和化学性质,较多纳米材料既可以用作药物递送载体,也可以用作免疫调节剂,有望改善肿瘤免疫抑制微环境。
石墨炔是新兴的二维碳材料,在催化、能源、生物医药等领域展现出广阔的应用前景。研究团队通过同位素13C标记氧化石墨炔(GDYO)及蛋白质组学方法,首次发现在巨噬细胞内GDYO表面可形成独特的蛋白冠,其中高度富集STAT3蛋白分子。STAT3是细胞内重要的信号转导蛋白和转录因子,与肿瘤的发生发展密切相关。研究表明,GDYO-STAT3的强相互作用影响了肿瘤相关巨噬细胞表型,使其由促进肿瘤的M2型逆转为抑制肿瘤的M1型,改善肿瘤微环境的免疫抑制,增加杀伤性T细胞浸润及激活,提高PD-L1抗体的疗效,提升免疫检查点疗法的疗效。
GDYO独特的sp和sp2碳原子和高度的π共轭结构,以及表面的氧化基团C-OH及C=O,影响其与生物分子之间的相互作用。GDYO与STAT3蛋白分子的强作用同时取决于GDYO的表面化学与STAT3蛋白的二级结构及序列,由结构匹配、氢键和盐桥驱动。这解释了GDYO-STAT3独特的强相互作用分子机制。该研究综合运用蛋白组学、高性能理论计算的分子机制解析及同位素定量技术,首次探究了巨噬细胞内纳米颗粒-蛋白质界面的相互作用机制,为深入理解纳米-生物界面调控纳米材料复杂生物学效应提供了新认识。
陈春英课题组致力于纳米材料-生物界面,尤其是与生物分子(蛋白质、DNA和脂质)互作的研究,并取得系列进展,发现碳纳米管通过快速吸附血液中的蛋白分子形成纳米蛋白冠来降低急性毒性(PNAS, 2011, 108, 16968-16973);研究Gd@C82(OH)22纳米粒子与临床肺癌患者血液中重要补体成分C1q蛋白分子发生特异性结合,改变C1q分子结构,激活先天性免疫反应(Nano Letters 2019, 19, 7, 4692-4701);报道二硫化钼纳米材料由纳米蛋白冠介导的独特的体内转运、代谢和生物利用过程(Nature Nanotechnology 2021, 16, 708-716)。这些研究为纳米生物效应与纳米医学研究提供关键、前沿的分析手段,推动了纳米生物医学的发展。
研究工作得到国家重点研发计划、国家自然科学基金、中科院战略性先导科技专项(B类)及广东省重点领域研发计划的支持。
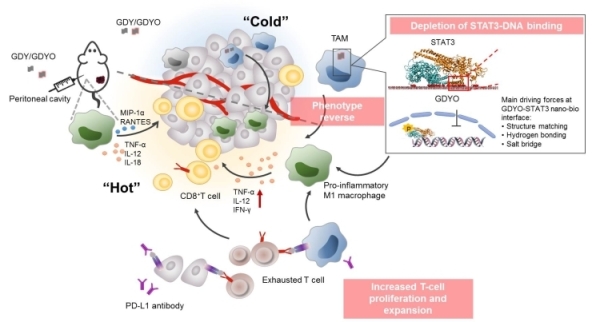
氧化石墨炔与其胞内蛋白冠相互作用改善肿瘤免疫抑制微环境
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。