 1914
2021-12-17
1914
2021-12-17
颗粒在线讯:导读:挤出式打印作为最常见的3D生物打印方法,面临的一个关键挑战是难以兼顾可打印性能和功能性,使得可供选择的生物墨水种类受到了极大的限制。近日,清华大学机械工程系熊卓和张婷课题组(BRE团队)在Advanced Functional Materials (最新影响因子: 18.808)发表题为“3D Printing of Cell-laden Microgel-based Biphasic Bioink with Heterogeneous Microenvironment for Biomedical Applications”的文章,开发了一种具有超弹性和异质组织微环境的载细胞微凝胶双相生物墨水(Microgel-based Biphasic Bioink, 简称MB生物墨水),能够将一系列水凝胶材料打印成具有高形状保真度的复杂结构,具有良好的超弹性能和机械可调性,能够实现微尺度异质组织微环境,扩展了现有生物墨水的应用范围,为生物医学应用(如组织工程、软体机器人)提供了新的解决方案。
本文第一作者为清华大学机械系生物制造中心博士后方永聪,通讯作者为清华大学机械系生物制造中心的熊卓副教授、张婷副研究员。本研究得到了清华大学人才引进启动经费基金(53330200321),国家重点研发计划项目(2018YFA0703004),国家自然科学基金面上资助项目(31771108),中国博士后科学基金站前资助项目(2021TQ0184)等项目支持。
背景介绍
3D生物打印技术因其能够将细胞和材料(如生物墨水)精确地堆积到三维复杂结构中而引起了人们的极大兴趣,该技术在体外生物系统工程中常用于构建病理模型和组织再生。目前已发展了多种生物打印技术,其中,最常见的方式是挤出式生物打印——通过数字化设计控制生物墨水的挤出与组装,然后迅速成型以保持打印结构的保真度。用于挤出式生物打印的生物墨水需要同时满足可打印性和功能性,但这通常来说是矛盾的,即浓度较高、粘度较高的生物墨水更有利于微丝挤出和结构稳定,从而获得较高的形状保真度,而浓度较低、密度较低的聚合物网络更有利于细胞的扩散、迁移和增殖。
近年来为解决这些问题,国内外的研究者们提出了很多的方法,诸如使用细胞团来制造复杂的组织结构、添加流变改性剂提高初始粘度较低的水凝胶生物墨水的可打印性、添加细胞相容性明胶提高打印能力、使用悬浮打印技术扩大打印窗口等,但同时也面临着机械性能较差、生物相容性差、生物墨水种类受限、残留影响打印结构等问题。
因此,BRE团队开发出一种载细胞微凝胶双相生物墨水,能够在不同聚合物浓度的水凝胶中进行3D打印。MB墨水由两部分组成:(ⅰ) 由载细胞微凝胶充当的分散相,(ⅱ) 由水凝胶前驱体充当的连续相。MB墨水在打印过程中具有优异的流变性能,打印的结构在交联后也具有极好的结构稳定性。相较于纯水凝胶、纯微球生物墨水(jammed microgel, 简称JM),MB生物墨水表现出超弹性和更好的循环拉-压性能。此外,通过在连续相内加入不同类型的细胞,在打印的微丝结构内能够形成异质细胞微环境。MB生物墨水的提出,为扩展现有生物墨水的应用范围开辟了新的途径,也为组织工程应用及生物医学应用提供了新的思路。
1. MB生物墨水的制备与3D打印
本研究开发的MB生物墨水由两部分组成:(ⅰ) 载细胞微凝胶在紧密堆积下作为分散相,形成了MB生物墨水的第一级网络; (ⅱ) 水凝胶前驱体作为连续相渗入微凝胶之间的空隙,在微凝胶之间形成第二级网络。使用5%甲基丙烯酰化明胶(GelMA)制备MB生物墨水进行测试,其中微凝胶使用了带有红色荧光标记的GelMA,连续相使用了绿色荧光标记的GelMA,通过荧光显微镜观察拍照,发现连续相能够按预期填充在微凝胶之间的空隙中,比较红绿的面积得到微凝胶和连续相在墨水中所占的比例(图1c 微凝胶平均直径约175μm,占比80%)。
MB墨水制备方法:(ⅰ) 将载细胞的水凝胶前驱体注入微流芯片件中,被连续的油相剪切形成微凝胶,并在之后的通道/步骤中交联成形;(ⅱ) 通过一系列“注液-离心-去除多余液体”的方式,将微凝胶之间的空隙替换为所需要的水凝胶前驱体。为平衡微凝胶中的细胞活性和微凝胶的结构稳定性,使用5.0wt% GelMA载C2C12细胞进行测试,以80mW/cm2光照强度交联35s,微凝胶中的细胞活性约为91.5%±4.2%。在微凝胶中使用Brdu染色标记增殖细胞,细胞增殖率从≈30%(Day1)提高到69.8%±8.5%(Day11)。通过F-actin染色能够观察到C2C12细胞在微凝胶外表面迁移扩散。通过微流控方式能够使用多种材料、大小和细胞密度来制备载细胞微凝胶,为进行验证,本研究制备出了细胞密度高达5×107/mL的微凝胶。
使用载C2C12的MB生物墨水进行打印实验,其中微凝胶直径203.5±14.8μm,打印的微丝直径535±35.2μm。通过改变离心过程的离心力可以调节微凝胶的压实情况,但对微凝胶中的细胞活性会造成影响,在270G和500G离心力下生成的MB生物墨水,其细胞活性分别为80.3%±3.6%和73.3%±3.4%。在打印和二次交联后,受剪切力和光照影响,微凝胶中的细胞活性由91.5%±4.2%下降为62.8%±7.4%。尽管打印后的C2C12初始活性相对较低,但随培养时间的延长,细胞的生长速度较快,从D1到Day13,微丝内的细胞增殖率增长了十余倍,同时,在Day7时细胞活性>95%。在Day10-14,C2C12迁移至微凝胶外表面,进一步渗入微凝胶之间的空隙。
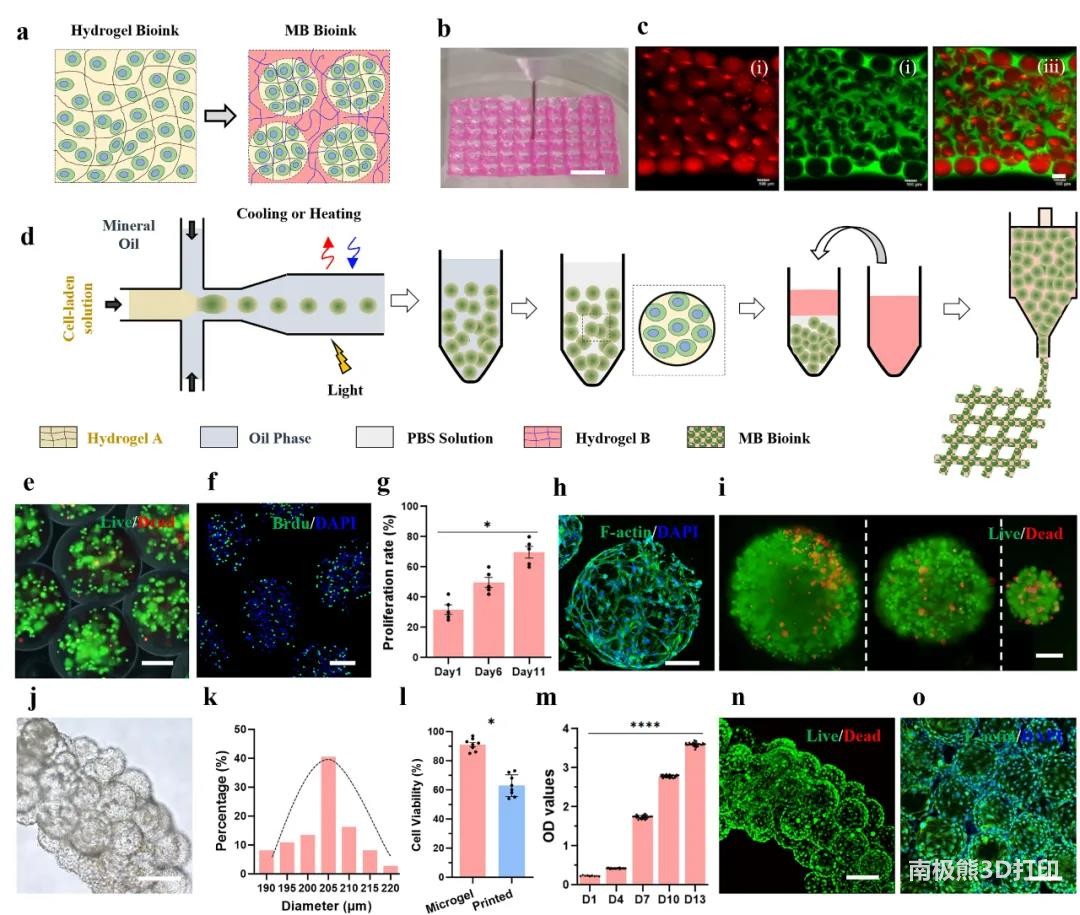
图1 载细胞MB生物墨水的制备与3D打印
2. MB生物墨水的流变性能
使用5.0wt% GelMA制备MB墨水、纯GelMA墨水、JM墨水测试流变性能。三种墨水在室温下均表现出剪切稀化性质。在温度测试方面,纯GelMA墨水会随温度的升高出现凝胶-溶液的转变,JM墨水不受温度影响,MB墨水在4-35℃范围内也始终保持凝胶状态,因此,相比于纯GelMA墨水,MB墨水在一定程度上摆脱了温度的限制,拓宽了打印窗口。
考虑MB墨水微凝胶含量(M.F.≈80%/85%/95%)对于流变性能的影响,三组墨水均表现剪切稀化性质,但墨水的粘度和屈服应变会随M.F.的增加而增大,表明在更密实的堆积情况下,需要更大的应变来破坏微凝胶之间的连接,同时墨水在4-37℃条件下均能表现自愈合性质。
考虑MB生物墨水受连续相的各种交联策略的影响,分别使用PBS、海藻酸钠和GelMA作为连续相,均表现出剪切稀化性质和应变屈服性质,因此MB墨水流变性能取决于微凝胶堆积的密实情况,而与微凝胶的组成和连续相无关,但连续相会影响打印结构的结构稳定性和力学性能。
使用低浓度GelMA(3.75wt%)和海藻酸钠(0.5wt%)制备微凝胶,其中3.75wt% GelMA微凝胶在PBS溶液中能够保持长期的稳定,细胞活性为67.5%±9.1%,0.5wt%海藻酸钠微凝胶内的细胞活性为85.3%±6.4%,将两种微凝胶与GelMA连续相混合制成的MB墨水也能表现出类似的剪切稀化性质和应变屈服性质,可作为墨水用于挤出式生物打印。
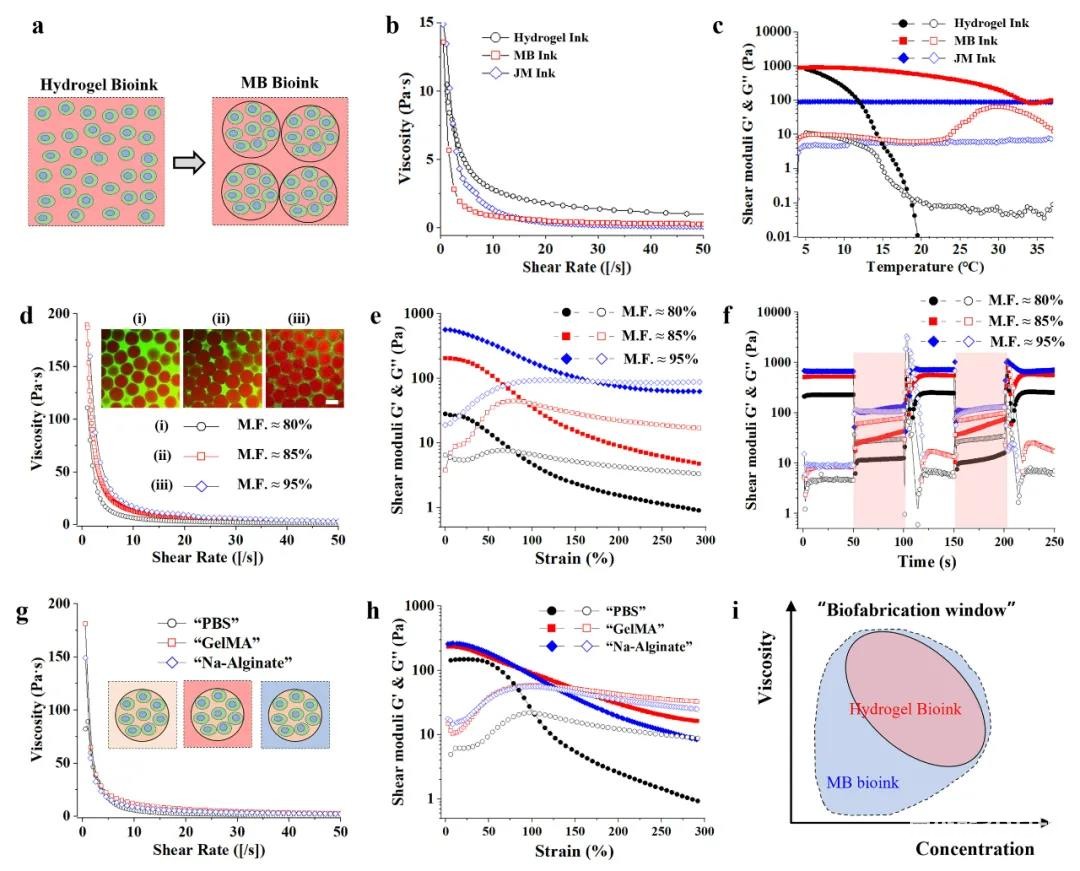
图2 MB生物墨水的流变性能表征和组分多样性
3. MB生物墨水的可打印性
为验证MB生物墨水的可打印性,使用内径510μm的喷嘴(21G)进行悬空挤压,微丝直径接近喷嘴,挤出3厘米后才因重力而断裂。MB墨水由于阻力较小,在打印过程中能够实现均匀挤出,而JM墨水在打印过程中出现堵塞和不连续的问题。对打印参数进行优化后,打印了15.0×25.0mm2的多层网格,相邻层之间连接较好。在打印的双环结构中可以观察到打印丝的颗粒形态。由于MB墨水流变特性不受温度影响,喷嘴温度在15℃-30℃的范围内进行打印时,都不会影响打印的保真度,有利于在温度不稳定的极端环境条件下进行多材料3D打印和生物打印。
使用MB生物墨水打印标准管状结构来定量评估形状保真度,交联后测量打印结构的内径(I.D.)、外径(O.D.)和高度,它们略小于设定值(<5%)。使用纯GelMA生物墨水、MB生物墨水和JM生物墨水打印了直径为10mm的半球,将打印出来的半球投影在玻璃表面,形成一个完整的球体,通过Image J软件测量其直径和圆度。MB生物墨水打印的半球显示出更平滑的层间过渡,更接近设定值(如直径和圆度),表明MB生物墨水提供了更高的结构保真度。
在复杂结构方面,打印了厚血管、半月板、鼻子、耳朵和支气管等具有挑战性(悬垂、薄壁、分支等)的结构。同时也使用悬浮打印的方式打印了大脑模型,表面显示出了典型的折叠和褶皱区域,与数字模型进行对比,误差在0.5mm的比例约为94.6%。此外,3D打印结构在培养液中放置一周后,其几何形状和尺寸都保持不变。
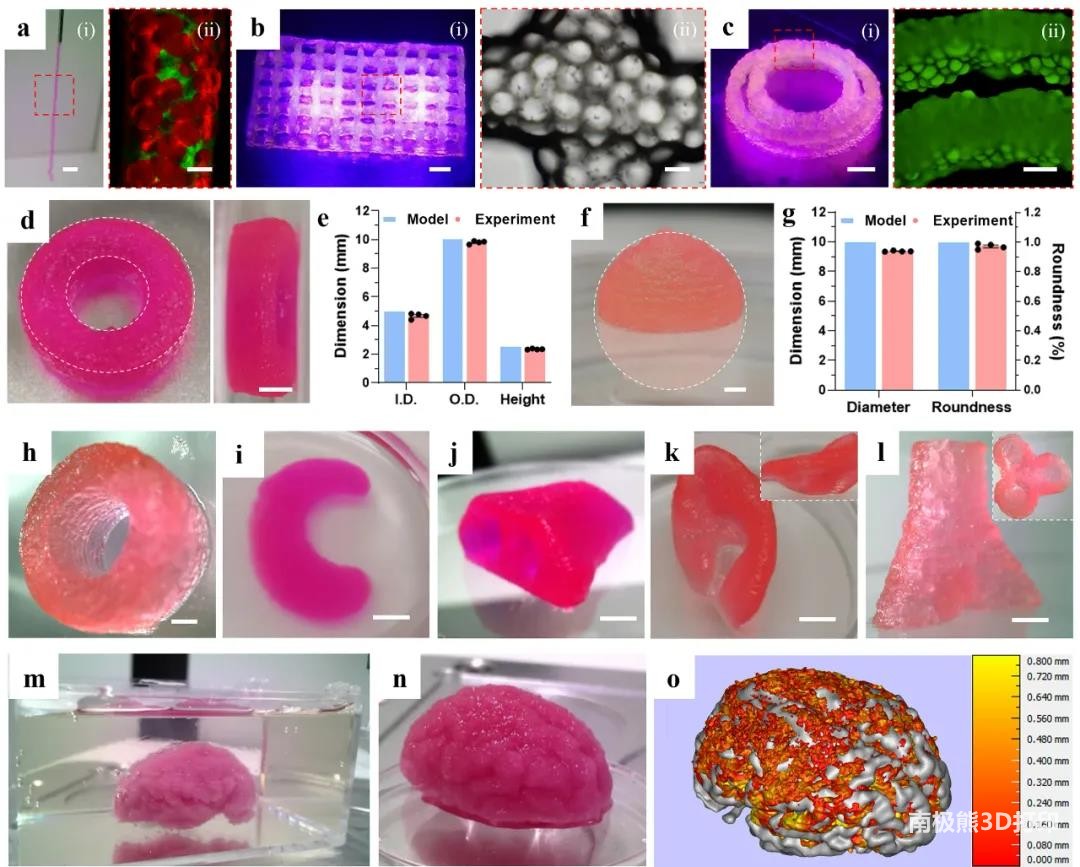
图3 MB生物墨水的3D打印性能和结构保真度评价
4. MB生物墨水的超弹性
使用5.0wt% GelMA制备的MB墨水、JM墨水、纯GelMA墨水打印直径10mm、高5mm的圆柱并比较力学性能,MB墨水(2.7±0.3 kPa)和JM墨水(2.2±0.2 kPa)弹性模量明显低于纯GelMA墨水(15.4±1.0 kPa),但却比纯GelMA墨水有更大的弹性,这可能是由于微凝胶的位移所产生的。对于MB墨水来说,微凝胶在压缩的情况下被限制在连续相中,因此与JM墨水相比,其弹性模量相对较高。
对于纯GelMA墨水,在40%应变的几个压缩循环后,疲劳裂纹很快在打印的圆柱内开始增长。同样,对于JM墨水,在60%的应变下,打印的圆柱在少于20次压缩循环后迅速疲劳,最大应力减小50%。然而,对于MB墨水,打印的圆柱可以在60%的应变下重复压缩1000次。MB墨水组的所有滞回曲线重叠非常好,表明其超弹性,在数千次加载下几乎未发生塑性变形。
打印了一些条带来检测在单轴拉伸和循环拉伸下的力学性能,MB条带在拉伸时的断裂应变(141.7%±5.2%)远高于纯GelMA条带(63.8%±3.1%),MB条带弹性模量(4.3±0.7 kPa)远低于纯GelMA条带(20.7±1.2 kPa),与压缩的结果一致。而JM条带的机械性能较弱,很容易在拉伸下断裂,表明添加连续相来将微凝胶整合在一起对MB墨水至关重要。MB条带可以通过高达100%应变的极端变形拉伸,并在松弛后恢复到原来的形状。冻干结构的扫描电子显微镜(SEM)图像证实了MB墨水的特征粒度,断裂区域的大部分微凝胶看起来仍保持完整或完全脱离连续相。
在不牺牲打印性的情况下,可以通过调整微凝胶和连续相的刚度而改变MB墨水的机械性能。例如,通过调节光照强度和曝光时间调节GelMA微凝胶的硬度,由较硬的微凝胶(弹性模量65.3±11.6 kpa)构成的MB墨水打印的圆柱弹性模量为9.4±1.1 kpa,由较软的微凝胶(弹性模量为30.1±8.6 kpa)构成的MB墨水打印的圆柱弹性模量为4.7±0.7 kpa,这主要是由于更硬的微凝胶在压缩下变形较小所致。以5.0wt% GelMA(2.7±0.3 kPa)作为连续相的MB墨水比分别以2.5wt%GelMA(2.2±0.1 kPa)和1.5wt%海藻酸钠(1.7±0.2 kPa)作为连续相的MB墨水更硬、更坚韧。同时,较低浓度(2.5wt%)的GelMA和海藻酸钠作为连续相形成的MB墨水也表现出超弹性,在60%应变下压缩1000次后,疲劳裂纹没有扩展。在微凝胶/连续相内添加细胞后,MB墨水的压缩模量得到增加,可能是由于微凝胶和连续相中细胞的颗粒强化效应所致,但其循环性能似乎有所下降。
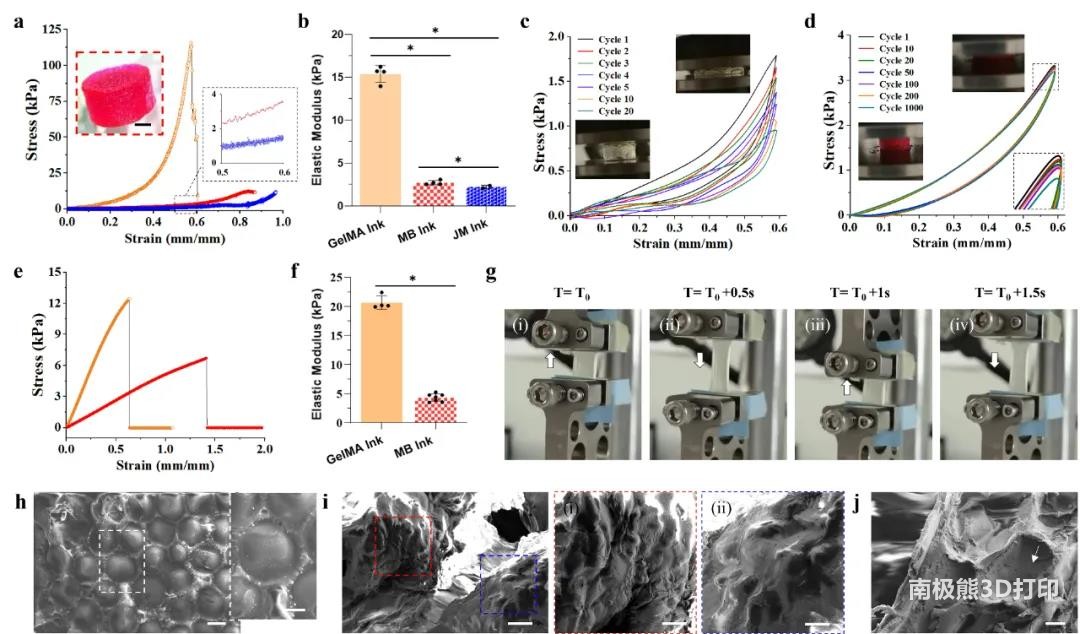
图4 MB生物墨水打印结构的力学特性
5. MB生物墨水的异质微环境对肝功能的促进作用
MB生物墨水可通过连续相、微凝胶分别包裹不同的细胞,从而在单个打印微丝内创建一个异质性的细胞微环境。将HepG2和HUVEC分别封装在7.5wt% GelMA MB墨水的微凝胶和连续中,同时HepG2和HUVECs以相同的细胞密度直接混合作为对照。载HepG2的微凝胶细胞活性约为90%,且能正常表达白蛋白,使用MB墨水打印的组织在长时间培养后保持了结构完整性和较高的细胞活性。
使用CellTrackerTM荧光探针对HepG2(红色)和HUVECs(绿色)进行标记。在MB墨水中,HUVECs主要分布在微凝胶空隙。与纯水凝胶墨水组相比,MB墨水组的HUVECs在第3天和第7天表现出更高的增殖率,形态拉长,可能是MB墨水中与内皮细胞限制相关的富集效应,导致肝脏和内皮细胞局部细胞密度增加以及细胞相互作用增强。在第6天用HepG2白蛋白和HUVECs抗血管性血友病因子(vWF)免疫染色打印的结构,观察到MB墨水中,HUVECs扩散较好,通过内皮细胞组装形成随机的管状血管结构,覆盖在HepG2微凝胶表面。与水凝胶墨水相比,MB墨水中毛细血管状网络形成更好(总长度、单位面积分支数、平均长度)。
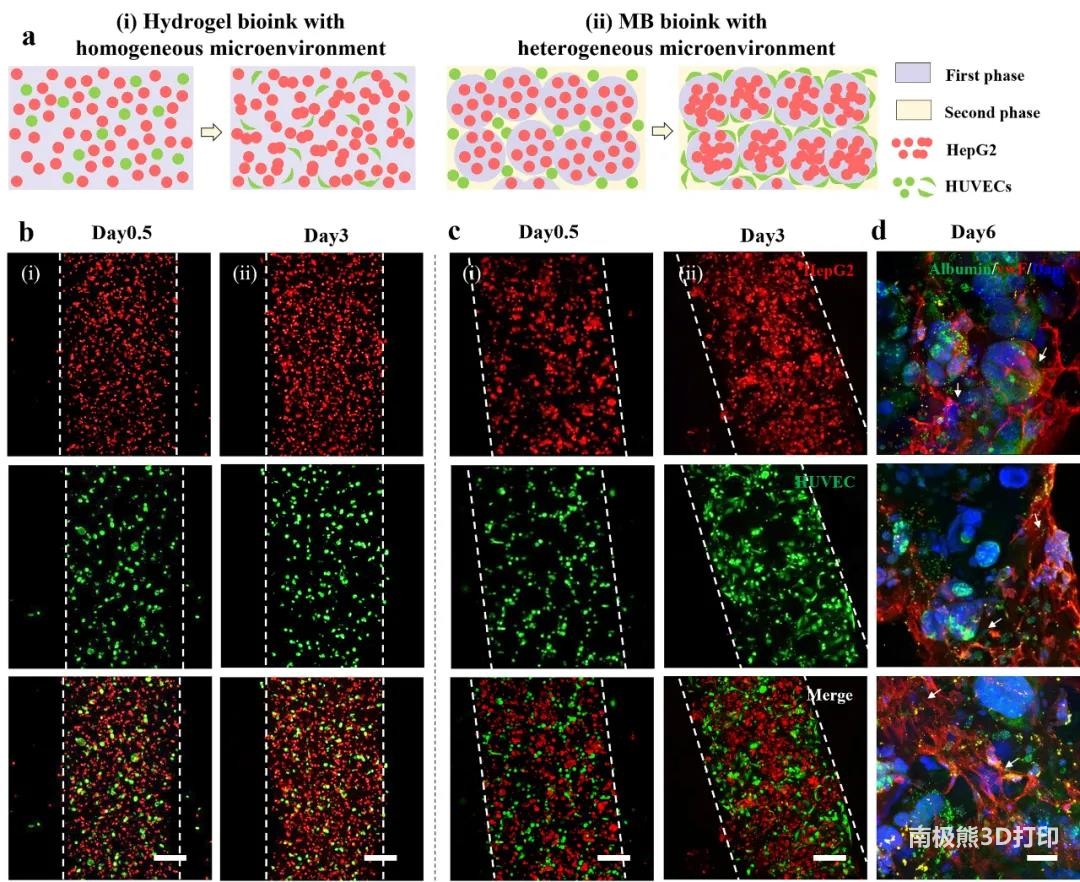
图5 3D打印构建具有可调异质微环境的血管化肝组织模型
相比于水凝胶墨水,MB墨水打印的肝组织表现出更高的增殖率。MB墨水组织和水凝胶墨水组织的白蛋白和尿素水平初始均低于二维培养模型,但在Day7时,MB墨水组>水凝胶墨水组>二维培养组。在细胞色素P450同工酶中选取CYP3A4和CYP1A1评估酶活性,结果表明,MB墨水组>水凝胶墨水组>二维培养组。
与水凝胶墨水组相比,MB墨水组的成熟肝脏标志物TTR、ALB在Day10的表达水平明显升高,而胎儿肝脏标志物AFP的表达水平无明显差异。western blot分析显示,与水凝胶墨水组相比,MB墨水组总体白蛋白和MRP2蛋白水平较高。此外,MB墨水组第7天CD31表达显著升高。这些发现证明了MB墨水中肝细胞的基因和蛋白表达更为成熟。
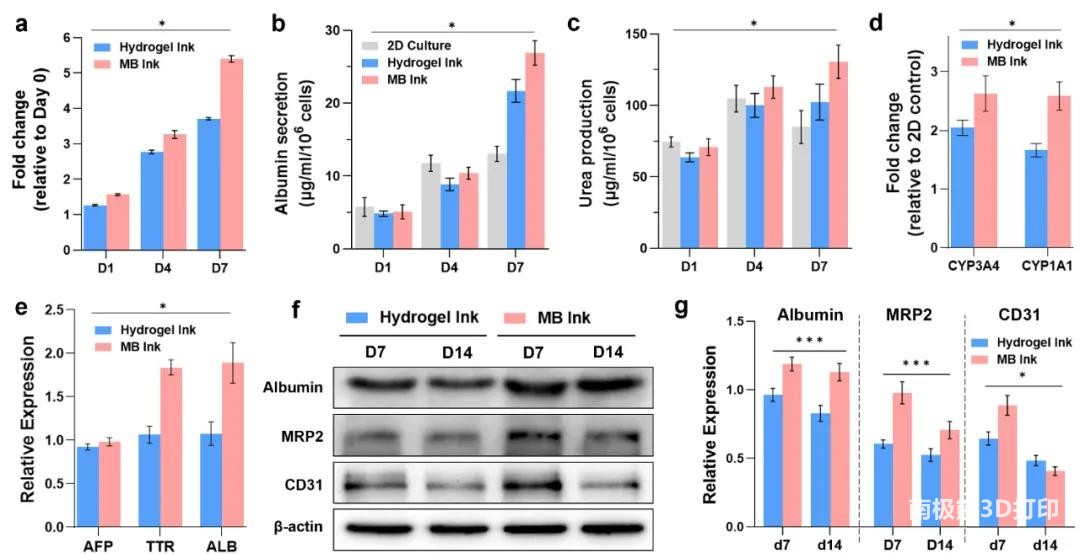
图6 肝功能检测及肝特异性基因和蛋白表达水平
总结
本研究中,BRE团队开发了一种由微凝胶和连续相所组成的载细胞双相生物墨水,能够通过墨水的流变特性(如剪切稀化、应变屈服、自愈合)提供更宽的生物打印窗口和优异的生物打印能力。该生物墨水具有很好的超弹性能,同时能够通过在微凝胶和连续相中添加不同类型细胞的方式,来构建具有异质细胞微环境的组织模型,为生物墨水的设计提供了更灵活的选择。未来,载细胞双相生物墨水可以进一步与当前的打印策略相结合,以更好地模拟天然组织和器官的结构复杂性和异质性,同时也拓展了3D生物打印在组织工程和软体机器人等生物医学领域中的应用。
参考阅读:
Yongcong Fang, Yihan Guo, Mengke Ji, Binhan Li,Yujiang Guo, Jieming Zhu, Ting Zhang*, Zhuo Xiong*, 3D Printing of Cell-LadenMicrogel-Based Biphasic Bioink with Heterogeneous Microenvironment for BiomedicalApplications, Advanced Functional Materials, 2021, 2109810.
https://doi.org/10.1002/adfm.202109810
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。