 2631
2022-12-22
2631
2022-12-22
颗粒在线讯:肝胆癌,包括肝细胞癌(HCC)是全球范围内的高致死性癌症。大多数HCC患者在确诊时已经处于疾病的晚期。而在肝癌发生的早期阶段,如果及时发现仍有治愈性治疗方法,但现在对HCC结节进行准确诊断的需求尚未得到满足。与大多数癌症在治疗前需要确认活检不同,磁共振成像(MRI)是无创的,已被临床推荐用于建立HCC的诊断和分期,其中造影剂(CA)被用来选择性地调节(磁共振)MR信号,以提高肿瘤的可见度。因此,早期肝癌的体内磁共振检测特别依赖于敏感和特异的CAs,以安全地观察复杂的肝脏系统中细微的分子改变。尽管在设计和合成肝细胞特异性CA方面取得了进展,但由于缺乏敏感和特异性造影剂,其临床实用性受到阻碍,部分原因是肝细胞特异性纳米颗粒,无论其表面配体如何,都很容易被吞噬细胞吞噬。

基于此西北大学樊海明教授课题组在兔子,猪和猕猴中表明,肝胆MRI的性能可以通过由锰铁氧体磁芯(直径3nm)和聚(乙二醇)-乙氧基-苄基表面配体组成的超小纳米颗粒与肝细胞特异性跨膜金属和阴离子转运蛋白结合。与临床使用的造影剂钆塞酸二钠相比,纳米颗粒促进了更快,更灵敏和更高分辨率的肝胆MRI,大大提高了兔早期肝肿瘤的检出率(92%对48%),并且更准确地评估了猕猴的胆道梗阻。纳米颗粒的性能和生物相容性支持肝脏特异性MRI造影剂的进一步转化开发。相关成果以“A hepatocyte-targeting nanoparticle for enhanced hepatobiliary magnetic resonance imaging”为题发表在《Nature Biomedical Engineering》上,第一作者为张烨,Yingkun Guo和Ju Jiao。
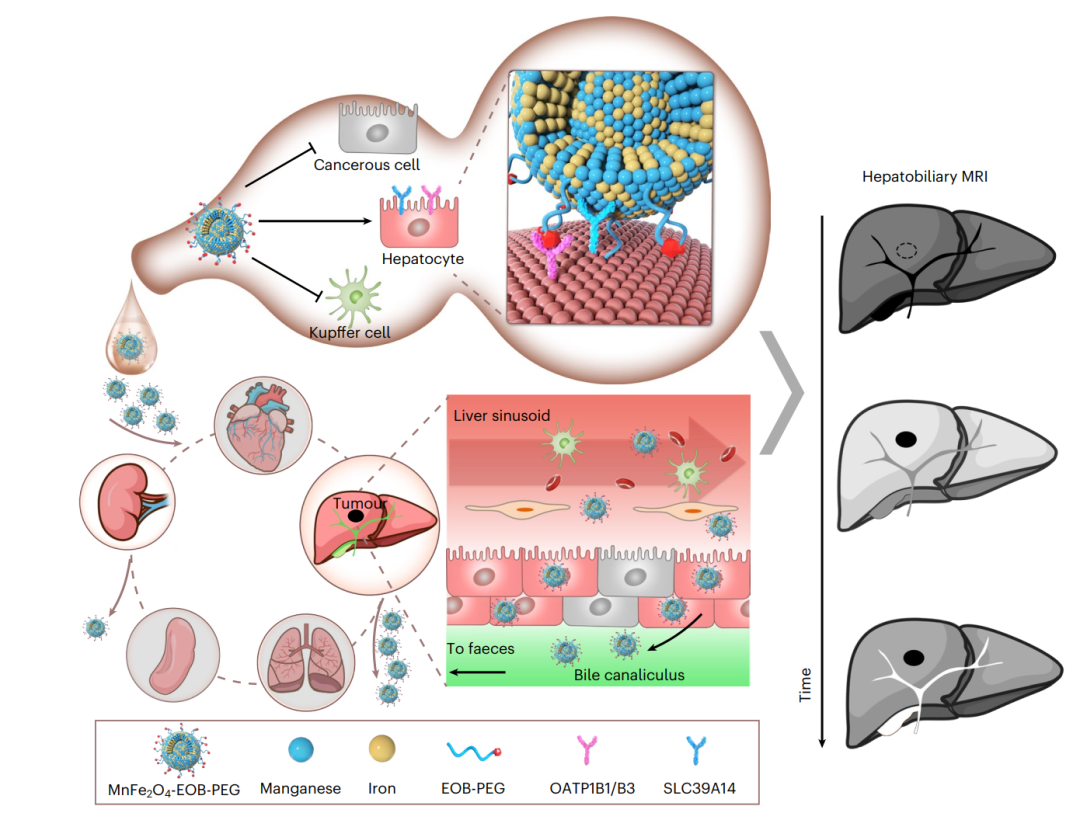
图1用于肝胆MRI的肝细胞特异性MnFe2O4-EOB-PEG纳米颗粒CA的设计
MnFe2O4-EOB-PEG的合成与表征
通过动态同步热分解法制备了平均尺寸为3nm的超小MnFe2O4纳米颗粒。然后,通过配体交换反应,将准备好的MnFe2O4纳米颗粒与多巴胺-PEG-EOB分子共轭,得到了足以用于大型动物研究的克级的MnFe2O4-EOB-PEG。透射电子显微镜(TEM)显示,MnFe2O4-EOB-PEG纳米颗粒具有3nm的均匀尺寸(图2a)。通过动态光散射测量,MnFe2O4-EOB-PEG纳米颗粒的流体力学尺寸和多分散性分别为11.7nm和0.27(图2b)。用3T核磁共振扫描仪来评估MnFe2O4-EOB-PEG的松弛性。MnFe2O4-EOB-PEG表现出8.01 mM-1 s-1的高r1弛豫性,小的r2/r1比率为2.76(图2c)。此外,与大尺寸的纳米颗粒相比,超小的MnFe2O4-EOB-PEG表现出明显减少巨噬细胞的吞噬,证实了他们对单核巨噬细胞的逃避能力。
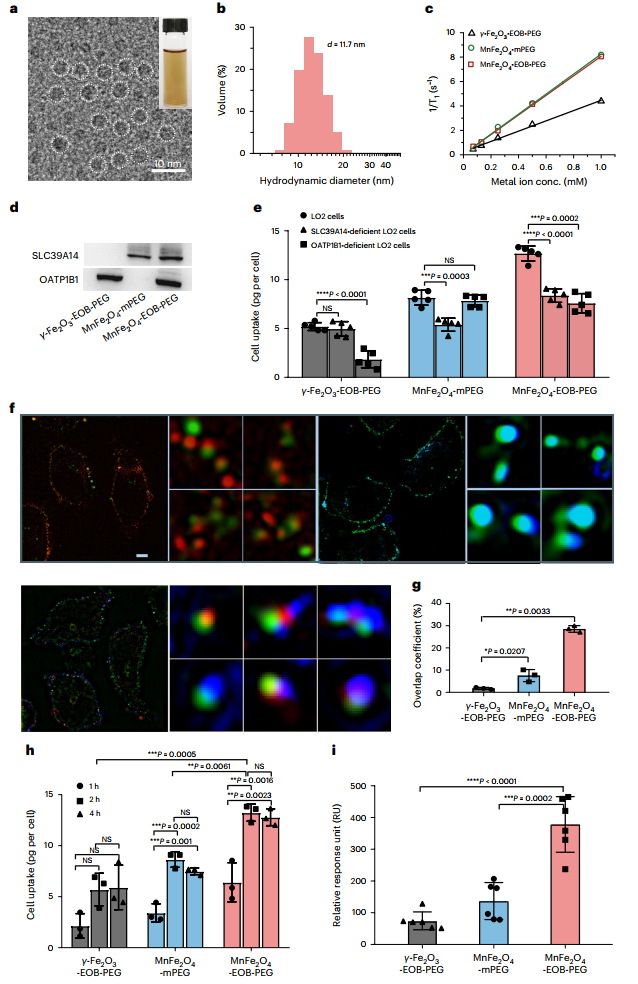
图2 MnFe2O4-EOB-PEG和体外肝细胞亲和力表征
体外肝细胞亲和力表征
为了确定可能介导MnFe2O4-EOB-PEG和肝细胞之间相互作用的潜在受体,作者首先在LO2人类肝细胞系中进行了共同免疫试验。如图2d所示,观察到SLC39A14和OATP1B1蛋白都与MnFe2O4-EOB-PEG有相互作用。相反,MnFe2O4-mPEG和γ-Fe2O3-EOB-PEG分别只与SLC39A14和OATP1B1蛋白相互作用。结果表明,EOB-PEG配体特异性地与OATP1B1结合,而SLC39A14是介导MnFe2O4纳米颗粒与肝细胞结合的受体。进一步用SLC39A14缺陷的肝细胞进行细胞吸收实验,发现SLC39A14表达下调后,MnFe2O4-EOB-PEG和MnFe2O4-mPEG的吸收量都明显减少,而γ-Fe2O3-EOB-PEG的细胞内量几乎没有变化(图2e)。
超分辨率结构照明显微镜图像提供了纳米粒子与受体结合亲和力的进一步证据(图2f)。γ-Fe2O3-EOB-PEG处理组有明显的γ-Fe2O3 EOB-PEG和OATP1B1荧光信号的共定位,而MnFe2O4-MPEG处理组显示出强烈的MnFe2O4-mPEG和SLC39A14信号的共同定位。有趣的是,对于MnFe2O4-EOB-PEG处理组,不仅有MnFe2O4-EOB-PEG的荧光信号与OATP1B1或SLC39A14的共聚焦,而且还观察到MnFe2O4-EOB-PEG信号与两个受体的共聚焦。如图2g所示,MnFe2O4-EOB-PEG的三色重叠系数急剧增加到~28.52%。这些结果表明,MnFe2O4-EOB-PEG与肝细胞的相互作用确实是由OATP1B1和SLC39A14共同介导的。
作者随后通过纳米颗粒与LO2人肝细胞共同培养来测量肝细胞的时间依赖性吸收。在所有指定的时间点,MnFe2O4-EOB-PEG的吸收量总是高于MnFe2O4-mPEG和γ-Fe2O3-EOB-PEG,表明MnFe2O4-EOB-PEG的肝细胞特异性吸收效率更高(图2h)。进一步采用表面等离子体共振(SPR)检测来评估这些纳米粒子与目标细胞裂解液蛋白的肝细胞亲和力。MnFe2O4-EOB-PEG的相对RU为378.5。比MnFe2O4-MPEG和γ-Fe2O3-EOB-PEG的大2.77和5.35倍(图2i)。这表明MnFe2O4-EOB-PEG与肝细胞的结合亲和力更强。
猪体内肝细胞特异性MRI和安全性评估
为了测试MnFe2O4-EOB-PEG在体内肝细胞特异性磁共振成像中的适用性,作者对猪的肝脏成像进行了对比增强磁共振成像。通过静脉注射MnFe2O4-EOB-PEG给药。γ Fe2O3-EOB-PEG和MnFe2O4-mPEG被设定为对照组。图3a-c是在注射纳米粒子后30分钟采集的典型MR图像。在注射MnFe2O4-EOB-PEG后,肝脏在T1加权MR图像中高度增亮,可以明显识别突出的结构细节。相比之下,γ-Fe2O3-EOB-PEG和MnFe2O4-mPEG在肝脏中的MR信号增强相对较低。为了确定体内肝细胞的特异性,通过对切除的肝脏进行组织学评估来调查纳米粒子在肝内的分布。染色的肝脏组织(图3a-c)显示,大部分MnFe2O4-EOB-PEG分布在肝细胞中,而γ-Fe2O3-EOB-PEG和MnFe2O4-mPEG出现在肝细胞和吞噬细胞中。这些结果清楚地表明,MnFe2O4-EOB-PEG的体内肝细胞特异性很高。肝脏的动态对比度-噪声比(CNR)(图3d)表明,注射纳米粒子后,肝脏CNR迅速增加,在注射后10分钟达到最高水平,然后逐渐下降。接着作者进行了药代动力学、生物分布和排泄研究,以研究基于纳米颗粒的CA在体内的表现。图3e显示了浓度时间曲线。MnFe2O4-EOB-PEG的分布和消除半衰期缩短,这意味着MnFe2O4-EOB-PEG被肝细胞快速吸收并迅速被胆汁清除。值得注意的是,30分钟时MnFe2O4-EOB-PEG的肝脏积累量比γ-Fe2O3-EOB-PEG和MnFe2O4-mPEG高3.26倍和2.97倍(图3f)。
为了证实MnFe2O4-EOB-PEG的生物相容性,作者在猪身上进一步评估了暴露于MnFe2O4-EOB-PEG后的血液学、组织学和神经学影响,包括血清生化测试、常规血液学评估和血红素和伊红(H&E)染色切片的组织学检查。在实验期间。在使用基于MnFe2O4-EOB-PEG的CA后,没有一头猪死亡,也没有观察到不良反应。在血清生化测试中,测量了几个重要的肝脏和肾脏功能参数(图3g)。注射后评估的任何参数都没有发现明显的变化,表明肝脏和肾脏功能未受影响。
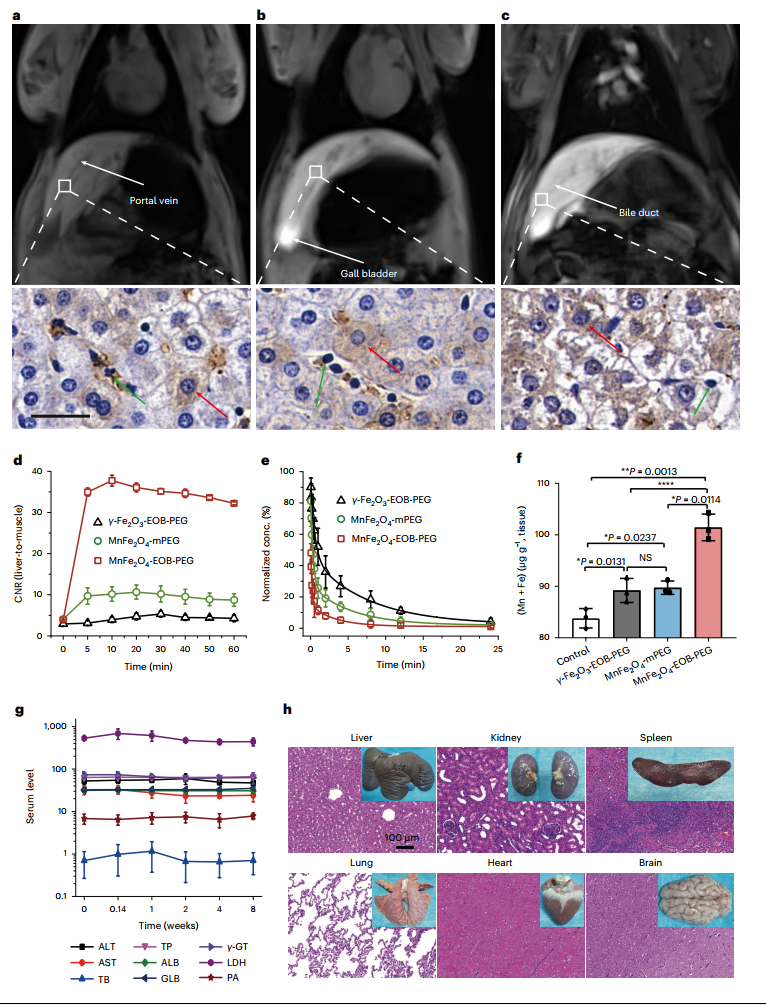
图3:猪体内肝细胞特异性磁共振成像和安全性评估
RI检测兔的小HCCs
为了证明MnFe2O4-EOB-PEG的潜在诊断优势。作者比较了MnFe2O4-EOB-PEG和SLC39A14共同介导的肝细胞特异性对小型HCCs的检测效果。随机选择一只兔子在MRI检查后被杀死,对切除的肝脏进行组织病理学检查。为了确保公平的比较,在肿瘤植入后的第7天,首先使用MnFe2O4-EOB-PEG对每只兔子进行MRI检查,48小时后,再次使用Gd-EOB-DTPA对兔子进行检查(图4a)。在MRI检查后,收集肿瘤,准备进行石蜡切片,并使用Pannoramic扫描仪进行观察。图4b显示了不同受体阻断处理后的VX2肿瘤负担兔的肝胆MR图像。图4c显示了相应的肝脏与肿瘤的CNR。对于对照组,两种CAs的T1增强图像显示肝脏肿瘤为低密度,而正常组织为高密度,表明由于OATP和SLC39的低表达水平,肝细胞特异性药剂很少被癌细胞吸收。图4d显示了一个2.35mm×2.60mm的肝脏肿瘤的典型肝胆MRI。由于MnFe2O4-EOB-PEG的高T1信号增强和高肝细胞特异性,使用MnFe2O4-EOB-PEG可以清楚地识别 "黑暗 "的肿瘤。事实上,MnFe2O4-EOB-PEG对非常小的肝脏肿瘤的检测率高达92%,远远超过Gd-EOB-DTPA(图4e)。
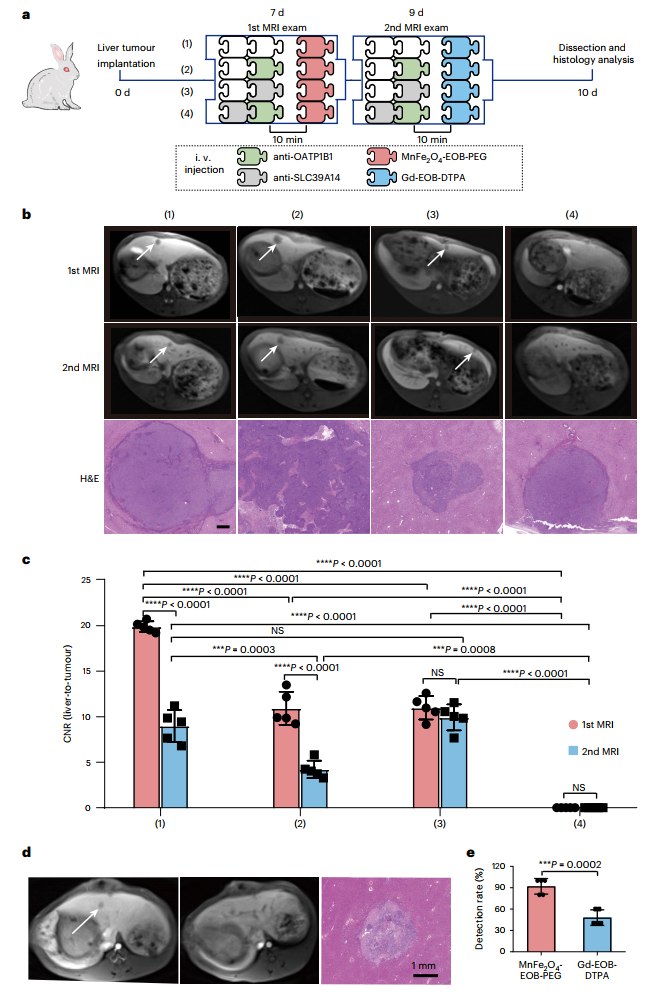
图4:兔子肝脏肿瘤的MR检测
猕猴的肝胆道成像
由于肝细胞特异性药剂的独特的肝脏消除作用,在诊断肝胆道相关疾病方面,肝胆道MRI比使用细胞外CA的传统动态MRI提供了额外的功能。因此,作者比较了MnFe2O4-EOB-PEG和Gd-EOB-DTPA在猕猴身上的肝胆道成像性能。首先采集两种CA的健康猴子的动态MRI,尽管MnFe2O4-EOB-PEG的剂量比Gd-EOB-DTPA更低,但在肝胆期,MnFe2O4-EOB-PEG在肝实质和胆管的信号增强更明显(图5a, b)。MnFe2O4-EOB-PEG的肝实质和胆管的最大CNR比Gd-EOB-DTPA高6.72倍和10.53倍(图5c,d)。更重要的是,使用MnFe2O4-EOB-PEG获得了肝胆道的高分辨率MR图像,据此可以清楚地描绘出直径小至0.5毫米的肝管。在注射MnFe2O4-EOB-PEG后,胆管的CNR迅速增加,并在20分钟达到最大值(图5d)。鉴于这一结果,作者进一步评估了MnFe2O4-EOB-PEG在肝胆道成像中诊断胆道相关疾病的潜力。为此,作者在开腹手术后,按照标准操作程序,通过部分结扎总胆管建立了胆道梗阻猴模型。MR胰胆管造影(MRCP)显示肝外胆管明显不连续,表明在猕猴中建立了胆道梗阻模型(如图5e所示)。
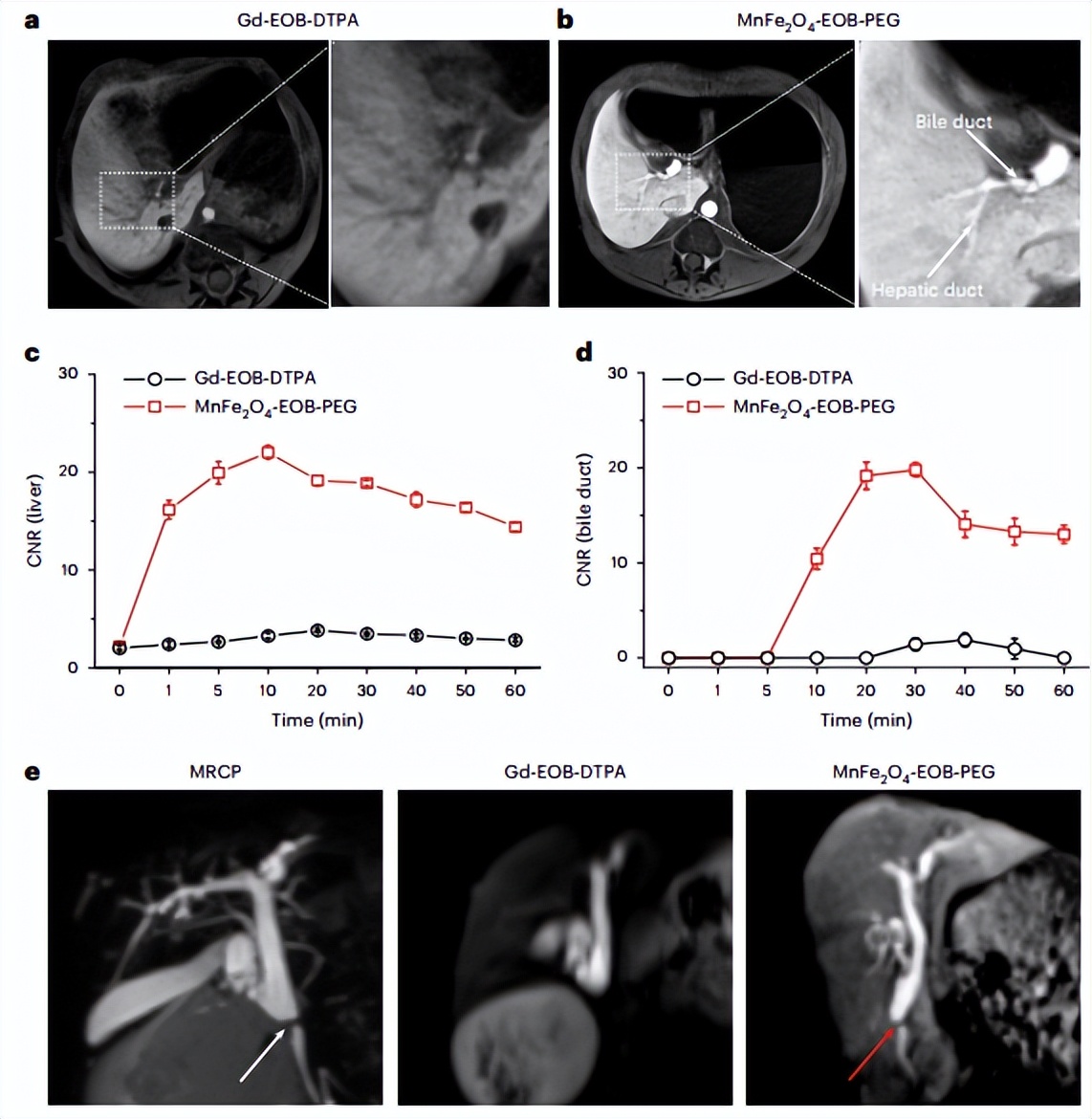
图5 猕猴的肝胆道成像
小结:作者开发了一种敏感的、具有生物相容性的MnFe2O4-EOB-PEG纳米粒子,具有优越的肝细胞特异性,可用于大型动物模型的高效肝胆MRI。作者的研究表明,MnFe2O4-EOB-PEG与临床上使用的Gd-EOB-DTPA相比,在小肝脏肿瘤和其他病变的无创磁共振诊断方面具有相当大的优势。再加上良好的生物相容性,MnFe2O4-EOB PEG作为新一代肝脏特异性磁共振成像CA具有很好的临床潜力。
来源:高分子科学前沿
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。