 1766
2023-01-09
1766
2023-01-09
颗粒在线讯:炎症性肠病(IBD)包括克罗恩病(CD)和溃疡性结肠炎(UC),是一种复杂的、多因素的免疫介导的疾病。全球约有690万IBD病例,并且这一数字还在增加。2020年,美国约有250万IBD病例,预计到2030年,这一数字将增加到350万。每年有33,000个新病例被诊断。大约30% - 40%的CD患者会发生肛周瘘(PAF)。CD-PAF估计每年影响15,000多名新患者。CD-PAF可伴有肛周疼痛、脓性或污性引流、明显的大便失禁和叠加感染。CD-PAF的这些并发症与生活质量下降和发病率相关。目前的临床治疗策略旨在促进瘘管的长期愈合,同时避免尿失禁和转流造口。然而,这些方法的成功率不到50%。例如,随机临床试验表明,英夫利西单抗(一种肿瘤坏死因子-α (TNF-α)抗体,是治疗管腔炎症最有效的方法之一)仅诱导23%的CD-PAF完全闭合。其他药物治疗,包括抗生素或免疫调节剂,在CD-PAF的长期治疗中效果更差,多达70%的瘘管在停止治疗后复发(15-17)。另一种治疗CD-PAF的方法是手术。不幸的是,解决CD患者PAF的手术干预措施受到以下因素的影响:瘘管频繁复发,以及可导致大便失禁的局部并发症(如肛门括约肌损伤)。
基于此,美国约翰霍普金斯大学Florin M. Selaru教授和毛海泉教授合作发现了一种可注射、生物可降解、机械可破碎的纳米纤维-水凝胶复合材料(mfNHC)负载脂肪来源干细胞(ADSCs),用于治疗CD-PAF大鼠模型的瘘管。与外科手术治疗相比,负载ADSCs的mfNHC治疗瘘管的愈合程度更高,是一种标准治疗方法。与外科治疗相比,mfNHC治疗的瘘管体积减少了6倍。分子研究表明,mfNHC的使用减少了局部炎症并改善了组织再生。本研究表明负载ADACs的mfNHC是一种有前景的CD-PAF治疗方法,值得进一步研究将mfNHC推向临床转化。相关工作以“A nanofiber-hydrogel composite improves tissue repair in a rat model of Crohn’s disease perianal fistulas”发表在《Science Advances》。
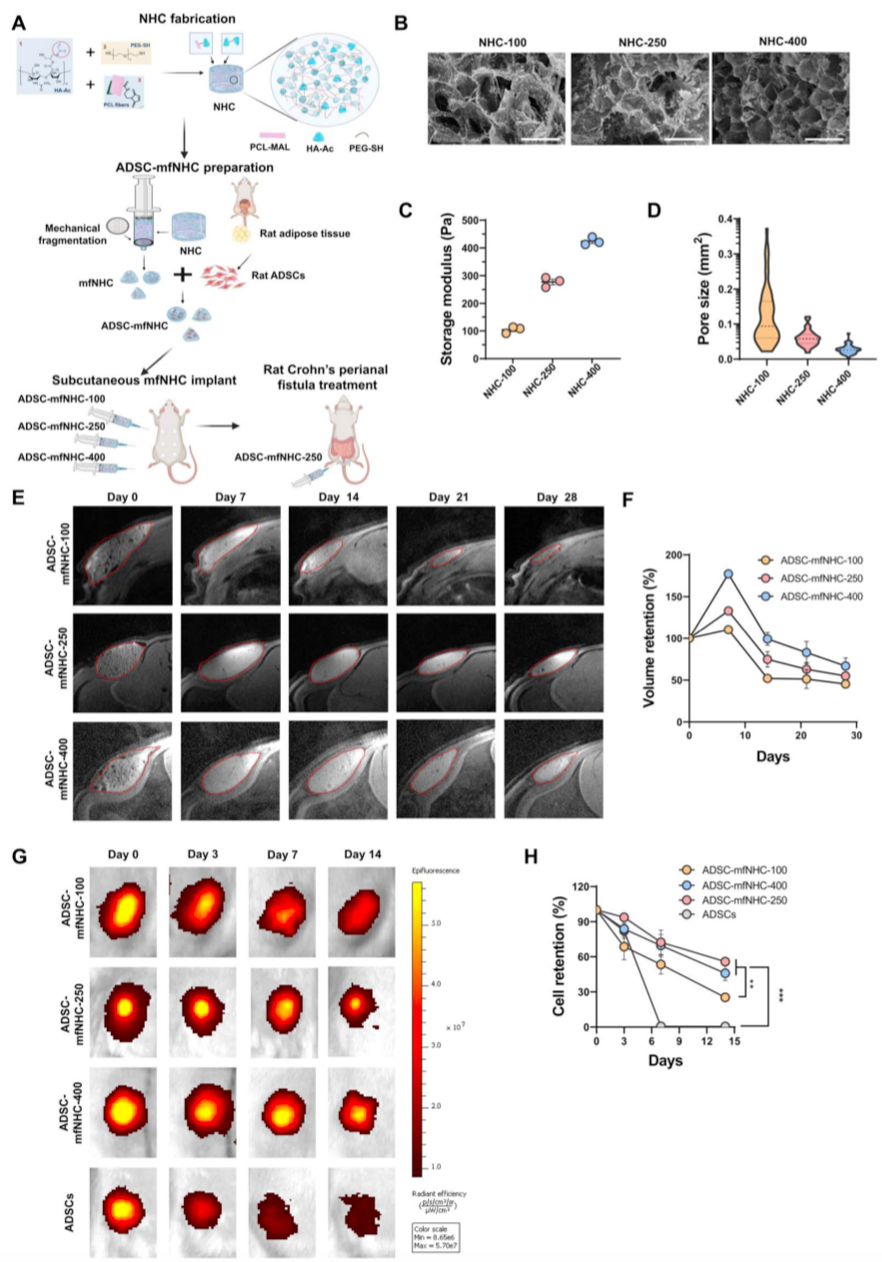
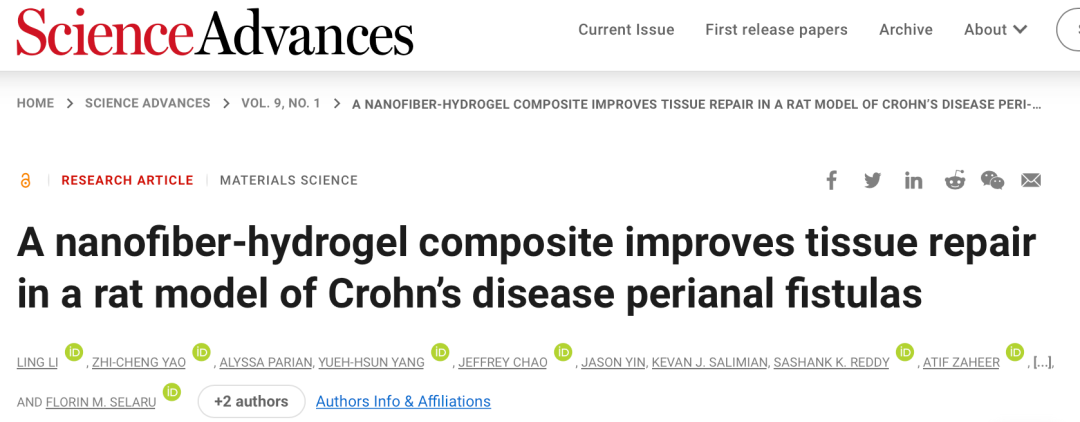
图1. ADSC-mfNHC的合成与表征
刚性和孔径可调的mfNHC的制备
mfNHC是通过将PCL纤维碎片与HA水凝胶结合来合成的。为了便于给药,研究者开发了一种可以注射到瘘管内的NHC复合材料。研究者设计并合成了几个刚度水平的mfNHC,以确定最优的材料刚度,允许注射到瘘管中,以及宿主细胞浸润到复合材料中。首先,研究者调整了复合材料的孔径大小,因为这一力学特征直接影响宿主再生细胞迁移到复合材料中的能力。首先,HA与丙烯酸缩水甘油酯反应,将丙烯酸酯基团与HA结合,生成NHC前体,丙烯酸酯修饰的HA (HA- ac)。接下来,如前所述制备静电纺PCL纳米纤维。然后用等离子体对PCL纤维进行表面活化,得到PCL纤维表面的羧基,然后将羧基转化为巯基反应性马来酰亚胺(MAL)基团,生成MAL功能化的PCL纤维(MAL-PCL)。将功能化的PCL纤维冷冻成长度为40 ~ 80 μm的碎片。然后通过在37 ℃交联HA-Ac、MAL-PCL纤维和二巯基聚(乙二醇)(PEGSH) 16小时来制备NHC(图1A)。MAL-PCL纤维碎片和HA-Ac偶联到PEG-SH交联网络上,形成界面共价键,在胶凝过程中形成完整的复合材料结构(图1A)。由于NHC的力学性能和孔径大小由交联网络密度决定,研究者在保持MAL-PCL纤维含量不变的情况下测试了5、10和15 mg/ mL的多个HA浓度。HA浓度为5、10、15 mg/m L时,NHC刚度的实测剪切模量G '分别为100、250、400 Pa(图1C)。然后,使用之前报道的方法机械破碎NHC,将其通过一个均匀孔径为0.009英寸的不锈钢网,产生平均直径为131.3 ± 18.8 μm的mfNHC。
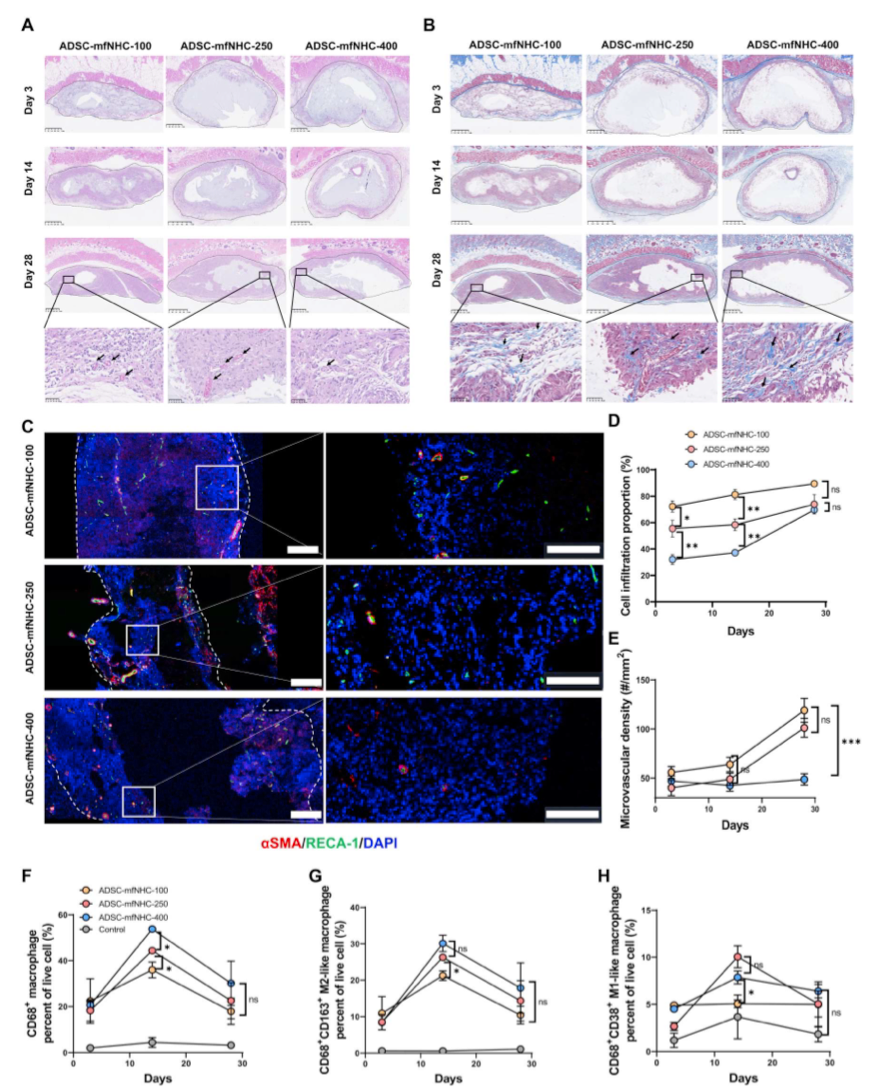
图2. ADSC-mfNHC植入物在大鼠皮下注射模型中的宿主细胞浸润、巨噬细胞极化和血管生成
宿主细胞迁移到mfNHC
研究者在不同的时间点收集mfNHC构建体,以分析宿主细胞浸润到构建体中的程度(图2A和B)。值得注意的是,mfNHC中只有微弱的马松三色染色(图2B),表明相对较少的纤维化和瘢痕形成。在第14日和第28日,mfNHC中有早期血管生成的证据(图2A-C)。如图2D所示,在最早的时间点(第3天),相对于mfNHC-250(55.4±11%)和mfNHC400(32.1±6.6%),mfNHC-100中有更多的宿主细胞浸润(72.4±7.3%)。这种趋势持续至第7天(mfNHC-100: 81.2±6.6%;mfNHC-250: 58.3±7.7%;mfNHC-400: 37.2±4.1%)。然而,在第28天,三组的宿主细胞浸润水平相当(NHC-100: 89.4±4%;mfNHC250: 73.9±12.7%;mfNHC-400: 69.7±4.1%)。在注射mfNHC后的早期,宿主细胞浸润到mfNHC的速度更快,硬度更低;然而,截至第28天,无论mfNHC硬度如何,宿主细胞浸润均大致相同。
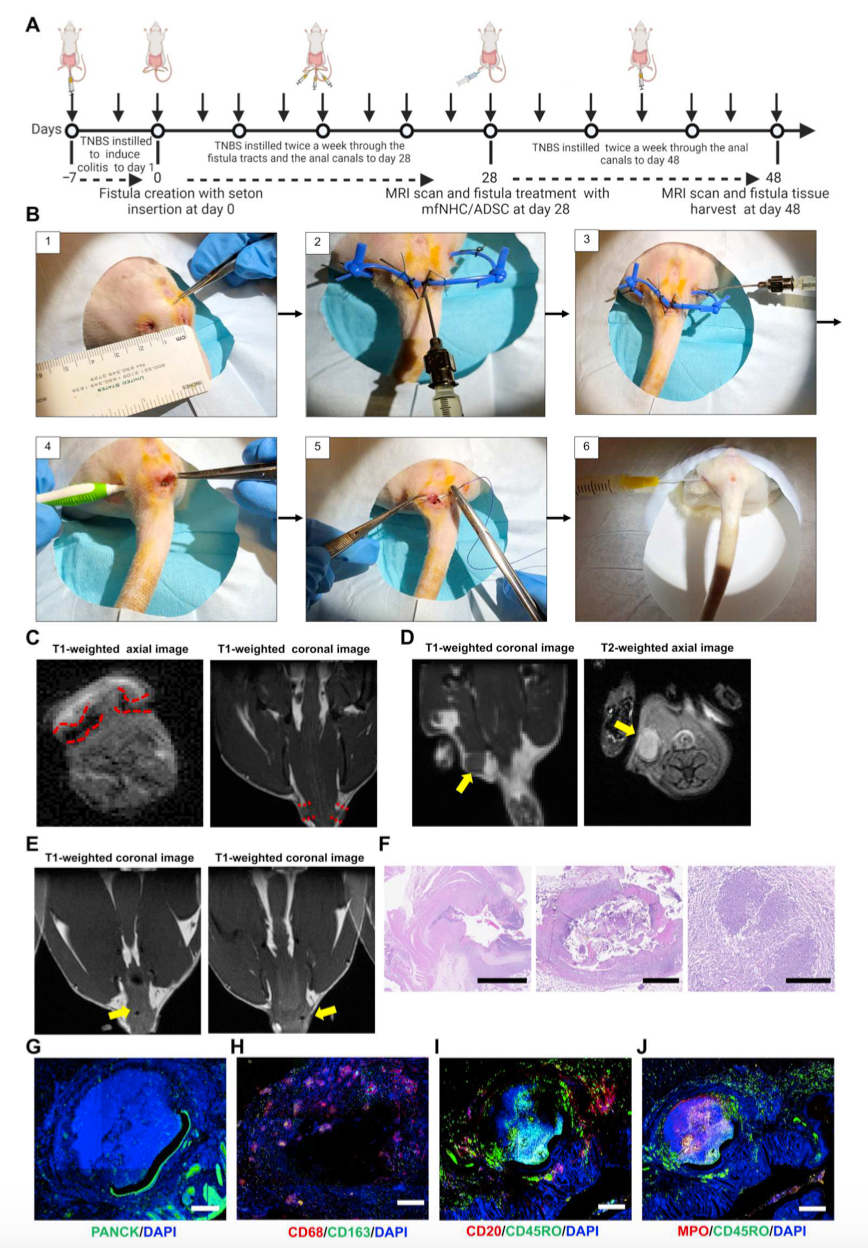
图3. CD-PAF大鼠模型的建立及表征
CD-PAF大鼠模型的建立与验证
人类CD-PAF瘘管环境具有炎症性且不利于愈合。研究者修改了先前发表的PAF在大鼠模型中的实验方案,以接近于模拟这种促炎症环境。简单地说,用2,4,6-三硝基苯磺酸溶液(TNBS)处理6只大鼠诱导结肠炎(图3,A、B)。所有大鼠均出现直肠炎/结肠炎的临床症状,包括粪便柔软、腹泻、直肠出血、肛门直肠黏膜肿胀、轻触黏膜出血等。大鼠在两次注射TNBS后开始出现症状。手术在3点钟和9点钟位置制造瘘管。在肛周皮肤选择距离肛门约1 cm的瘘管出口点。塞通被放置在新创造的通道中以保持它们的开放。研究者修改了Flacs等人报道的方案,以增加瘘管的严重程度。具体来说,研究者使用了更厚的挂线(截面为1.2 mm × 2.4 mm)和更大的内径,这意味着更难以治疗的模型。此外,为了维持炎症环境,在第28天瘘管治疗后,我们继续向小鼠直肠灌注5%的TNBS,每周2次,直到实验结束。在用TNBS冲洗瘘管的整个过程中,大鼠持续出现直肠炎症的临床体征(黏膜肿胀、软便、腹泻和直肠出血),这在CD-PAF模型中是理想的。TNBS灌洗瘘管4周后,对所有动物进行MRI检查,评估瘘管形成程度。如图3C中的代表性图像所示,在第28天对肛周区域左右两侧的两大通畅通道进行了成像。此外,瘘管周围有炎症的证据,偶见瘘管周围有脓肿(图3D)。在第28天拆除挂线。第42天复查MRI显示瘘管仍然通畅,表明瘘管已经成熟,没有自发愈合的趋势(图3E)。第42天处死动物,取瘘管组织行组织病理学检查。苏木精-伊红(he)染色显示,瘘管部分再上皮化,周围有明显的急、慢性炎症、肉芽组织和轻中度纤维化。也存在斑片状异物巨细胞型反应,偶见瘘道周围脓肿。我们还鉴定了肠腔内的粪便物质(图3F)。IF染色显示,扁平的泛细胞角蛋白(PANCK)阳性肠上皮细胞可能从瘘管的肠侧迁移,狭窄的鳞状上皮可能从瘘管的皮肤侧迁移(图3G)。我们使用IF染色对MPO +中性粒细胞、CD68 +和CD163+巨噬细胞、CD20 + B细胞和CD45RO +记忆T淋巴细胞进一步表征了瘘管内的炎症环境(图3,H至J)。
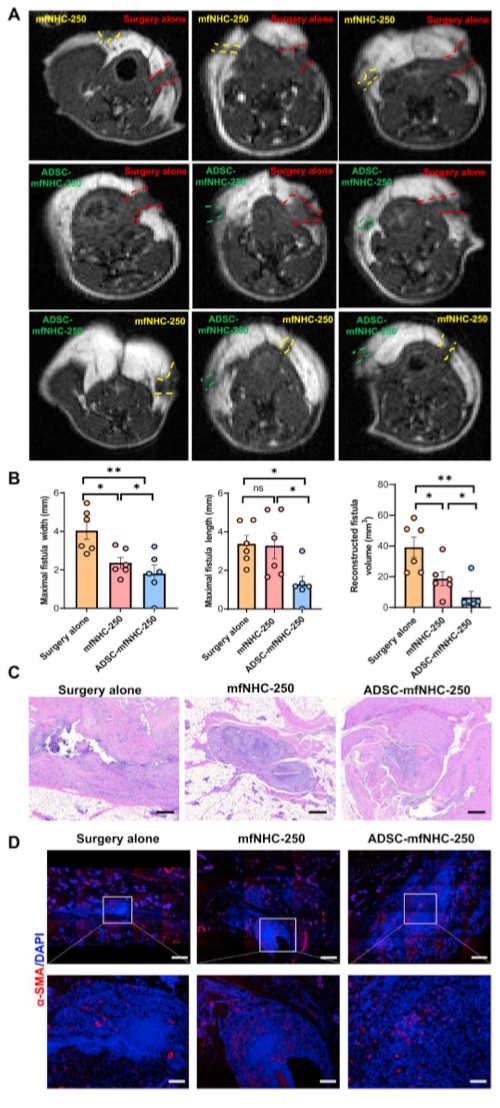
图4. ADSC-mfNHC-250治疗大鼠CD-PAF的疗效
mfNHC-250对大鼠CD-PAF模型的治疗效果
在CD-PAF大鼠模型中评估mfNHC-250的愈合能力。为了减少不同动物之间的个体差异,研究者选择治疗其中一个瘘管,并将同一动物的另一个瘘管作为手术对照。对照组和mfNHC治疗组瘘口均包括手术关闭内口。在关闭内口后,mfNHC通过瘘管的皮肤口插入治疗的瘘管。因此,mfNHC在治疗的瘘管内保留良好。mfNHC-250治疗后20 d行MRI检查。行肛周轴位和冠状位t1加权MRI扫描。如图4A所示,T1加权图像显示,与mfNHC-250单独治疗(无ADSC)相比,ADSC-mfNHC-250治疗的瘘口愈合更快,与单独手术相比,ADSC-mfNHC-250治疗的瘘口愈合更快。ADSC-mfNHC-250治疗组6例瘘管中2例完全愈合,其余4例内口和(或)外口闭合,愈合率超过80%。mfNHC-250组瘘管中度愈合,内口部分闭合;外孔保持开放;此外,ADSCmfNHC-250组的瘘道较ADSCmfNHC-250组更大。手术组的瘘口愈合情况最差,瘘道较大,内外口均开放。图中显示所有轴位和冠状位MRI扫描图像。从S7到S15。影片S1和S2显示了代表性瘘管的三维重建。图4B包含比较两个治疗组(ADSCmfNHC-250和mfNHC-250)和外科治疗组瘘口长度、宽度和体积的点图。手术组、mfNHC-250组、ADSC-mfNHC-250组的瘘管体积分别为(39.18±15.8)、(18.67±11.16)、(6.57±9.5)mm3。
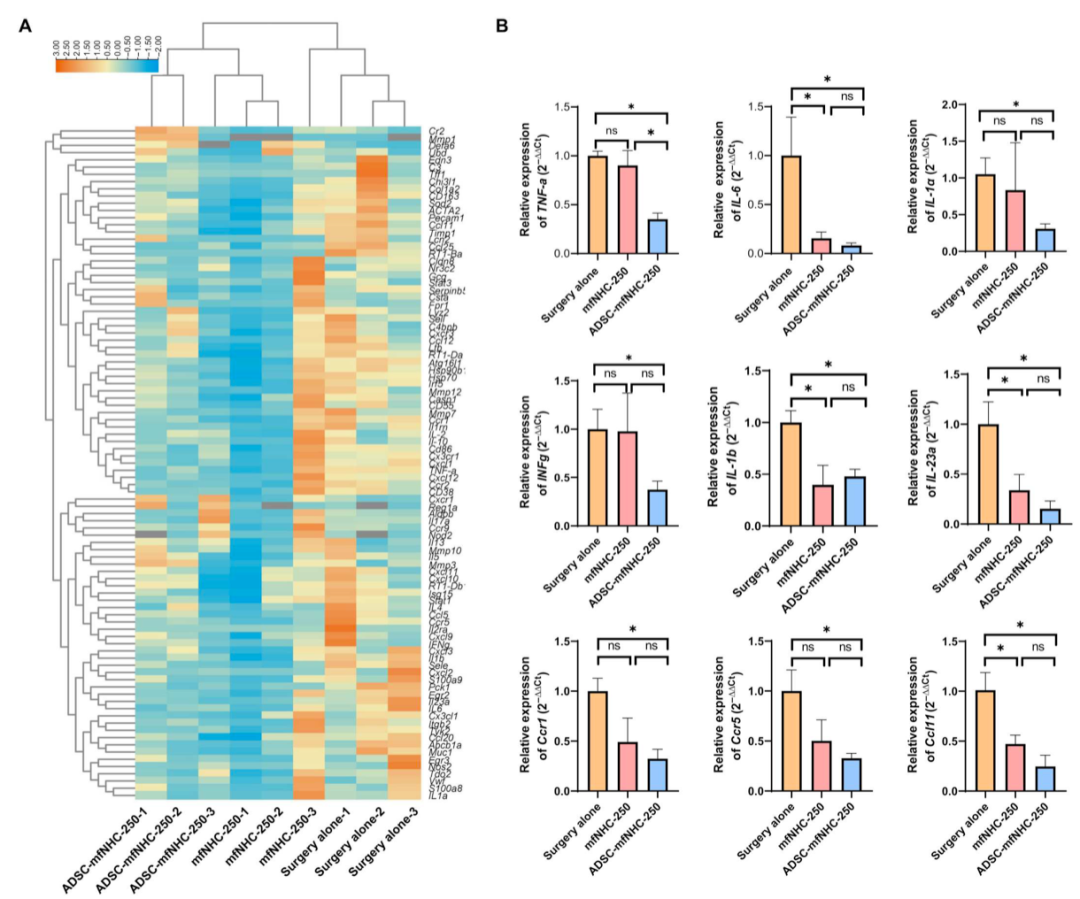
图5. RT-PCR阵列与治疗瘘管的RNA
ADSC-mfNHC-250处理对基因表达的影响
为了探索ADSC-mfNHC-250促进瘘管愈合的机制,研究者对从PAF组织中提取的RNA进行了实时聚合酶链反应(PCR)阵列。我们使用了含有CD-PAF相关基因的逆转录PCR (RT-PCR)芯片试剂盒。如图5A所示,ADSC-mfNHC-250处理抑制了与炎症和免疫相关的基因:Ccl11、Ccr2、Ccr5、Ccr9、干扰素-γ (IFN-γ)、白细胞介素-13 (IL-13)、IL-5、IL-6,以及与细胞外基质和纤维化相关的基因:Cx3cr1、Cxcl12、Cxcr3、ITGB2、Mmp1、Mmp10、Mmp12、Mmp3、Mmp7。Real-time RT-PCR对RT-PCR芯片中所选基因验证了这些发现。具体而言,与手术治疗相比,ADSC-mfNHC-250抑制TNF-α(2.85倍)、IL-6(16.7倍)、IL-1α(3.2倍)、IFN-γ(2.7倍)、IL-1β(2倍)、IL23α(6.7倍)、Ccr1(3.1倍)、Ccr5(3倍)和Ccl1(4倍)(图5B)。mfNHC-250单独抑制这9个基因中的4个:IL-6(6.7倍),IL-1β(2.5倍),IL-33(3倍)和Ccl11(2.1倍)。这些结果表明,ADSC-mfNHC-250抑制PAF的促炎和促纤维化环境,从而诱导组织修复。
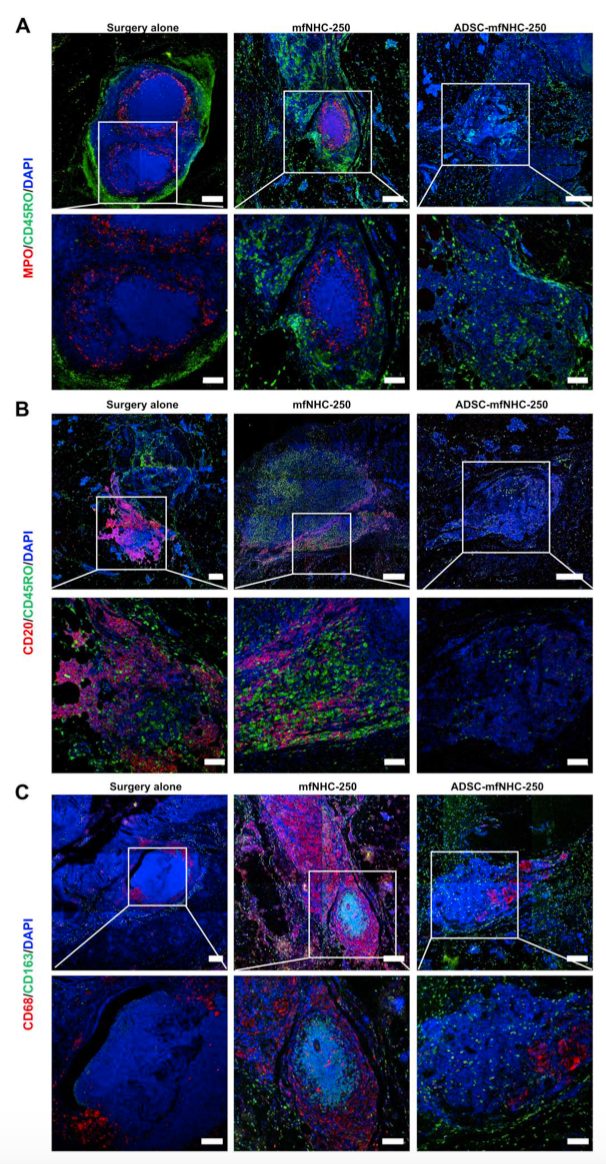
图6. 瘘管IF染色
ADSC-mfNHC-250处理对免疫细胞浸润的影响
为了研究治疗对局部免疫细胞的影响,研究者对所有治疗组的瘘管组织进行了IF染色。如图6 (A ~ C)所示,ADSC-mfNHC-250处理的瘘管与外科手术和mfNHC-250处理的瘘管相比,MPO+中性粒细胞、CD20+ B淋巴细胞、CD45RO+记忆性T淋巴细胞和CD68+巨噬细胞相对较少。为了进一步探索局部免疫细胞在三个治疗组中的分布,在每个治疗组结束时收集瘘管组织,分离成单细胞悬液,并通过流式细胞术分析。如图7 (A和B)所示,较少的CD11b+抑制了关键促炎细胞因子如IFN-γ、CCL3、IL6、TNF-α、CCL20和IL-17,增加了抗炎细胞因子如IL-4和IL-13。为进一步证实CD-PAF相关细胞因子的变化,采用酶联免疫吸附试验(ELISA)检测促炎细胞因子TNF-α、IL-6和抗炎细胞因子IL-10。图7E的结果显示,与手术治疗的瘘管相比,ADSC-mfNHC-250抑制TNF-α(2倍)和IL-6(1.5倍)。mfNHC250治疗组与手术治疗组间差异无统计学意义。ADSC-mfNHC-250可调节辅助性T细胞、巨噬细胞等免疫细胞的细胞因子分泌,具有加速瘘口愈合的净效应。
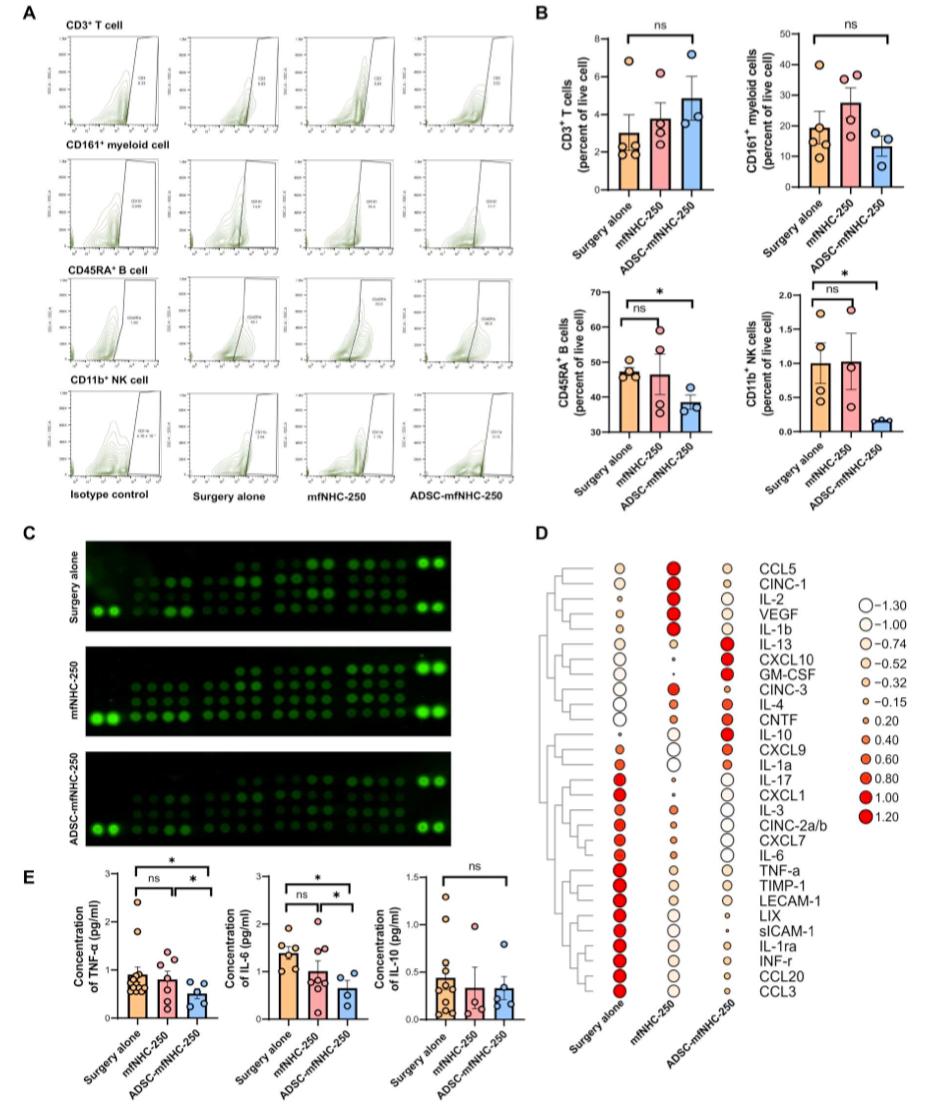
图7. 流式细胞术分析ADSC-mfNHC-250处理CD-PAF的免疫细胞分布及细胞因子谱分析
小结:研究者认为,针对管腔炎症的全身治疗(如生物制剂或小分子药物)需要与CD-PAF的局部治疗相结合,以最大限度地影响瘘管。理想的局部瘘治疗方法应直接应用于瘘道,以解决局部炎症,以及允许粪便、脓液和血液引流的生理缺陷。我们设计并测试了这种组织修复支架,以满足多种条件: (i)易于应用于瘘管,(ii)高孔隙率以允许再生宿主细胞迁移到支架中,(iii)高机械刚度以保持其在瘘管中的形状和完整性,(iv)免疫调节特性和增强的血管生成反应和血管生长到支架中,以及(v)共递送ADSCs并将其保留在复合材料中以最大限度地发挥ADSC在瘘管中的作用。为了满足这些设计标准,研究者创造了一种透明质酸(HA)水凝胶与电纺聚己内酯(PCL)纳米纤维碎片共价连接,形成完整的纳米纤维-水凝胶复合材料(NHC)。该NHC是机械破碎的(mfNHC),并负载ADSCs,然后在临床相关的CD-PAF大鼠模型中进行测试。
来源:高分子科学前沿
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。