 2796
2024-02-02
2796
2024-02-02
颗粒在线讯:2024年2月1日,美国食品和药物管理局 (FDA) 已批准3D 打印制药公司三迭纪(Triastek)继续执行其 3D 打印 T22 的新药研究(IND),使其成为第一个获得此指定的 3D 打印胃滞留产品。目前,Triastek正在准备启动T22 的临床研究,以加快产品开发。

Triastek 的 T22 产品是一种 505(b)(2) 产品,用于治疗肺动脉高压 (PAH) 和慢性血栓栓塞性肺动脉高压 (CTEPH)。T22 采用Triastek 的创新熔体挤出沉积 (MED) 加上微注射成型 (MIM) 工艺生产,并利用其胃滞留 3D 微结构 (3DμS-GR) 交付技术平台。与原研产品目前每日3次给药相比,T22将给药频率降低至每日1次,简化了给药方案并提高了用药依从性。
Triastek 的专有技术熔体挤出沉积 (MED) 3D 打印工艺与数字配方开发方法相结合,可实现复杂的药物输送和程序化释放。Triastek还积极开发新技术工艺,包括半固态挤出、微注射成型和微滴喷射。这些技术与 MED 的结合为药物输送和开发需求提供了广泛的解决方案,例如口服肽、胃滞留和高效产品。

Triastek 创始人兼首席执行官程森平博士表示:“基于我们专有的3D微结构胃滞留给药技术平台,我们开发的两款产品T20G和T22今年已获得中国和美国监管机构的IND许可,标志着Triastek在这一领域迈出了成功的第一步。 创新的运输技术平台正在通过监管审查程序。2021年,Triastek和SperogenixTherapeutics就T22在东亚的开发和商业化达成了共同开发协议,以展示3D微结构胃滞留输送技术的临床应用价值。基于T22的进展,多个国家和地区的公司表示有兴趣利用该药物输送技术平台进行产品开发的潜在合作。”
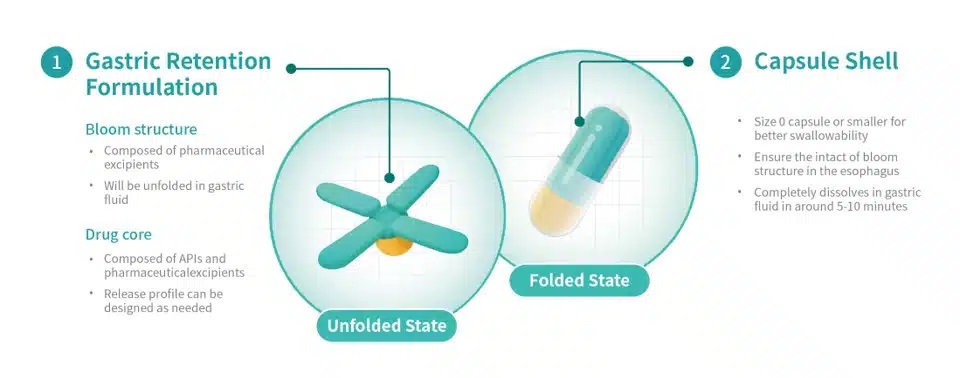
Triastek已完成T22胃滞留制剂的开发,在体外扩张时间、机械强度和溶出行为方面取得了积极成果,并完成了T22胃滞留原型在比格犬中的PK研究。据报道,药代动力学研究表明,每日一次给予相同每日总剂量的 T22 胃滞留试验原型可提供与原研产品 TID 剂量相当的 PK 参数。
随着T22获得FDA批准,Triastek共有四种3D打印药物产品(T19、T20、T21和T22)进入临床开发阶段,在全球3D打印药物领域排名第一开发产品数量。随着T系列管线的快速推进以及3D打印药物技术临床价值的不断验证,Triastek不断为全球市场开发新技术和新产品。目前,公司的两大主要业务模式包括“产品授权合作”和“技术平台合作”。
Triastek 开发的用于胃滞留输送技术的 3D 微结构及其独特的 Bloom 结构设计已提交 PCT 专利申请。口服给药后,胃滞留原型膨胀至大于幽门直径,从而延长胃滞留时间。在胃滞留期间,原型根据预定的程序药物释放行为释放 API。在简化给药方案、减轻用药负担、提高患者长期用药依从性的同时,还可以提高药物吸收和口服生物利用度,从而改善患者的治疗效果。
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。