 1280
2021-02-23
1280
2021-02-23
2月18日,国家纳米科学中心研究员陈春英课题组在Nature Nanotechnology(《自然-纳米技术》)上,在线发表了题为Molybdenum derived from nanomaterials incorporates into molybdenum enzymes and affects their activities in vivo的研究成果。该研究是体内纳米蛋白冠生物效应研究领域的最新成果,首次报道了含有必需微量元素钼的二硫化钼纳米材料由纳米蛋白冠介导的独特的体内转运、代谢和生物利用过程。
纳米材料/纳米药物一旦进入生命体系,将面对复杂的多重生物屏障和生理结构,纳米材料/纳米药物与不同的组织器官、细胞、生物流体微环境等复杂纳米-生物界面的互作方式是决定其被递送到目标部位的核心步骤。纳米-血液蛋白分子互作形成的“纳米蛋白冠”作为起始步骤,如何揭示“纳米蛋白冠”对纳米颗粒体内命运的影响是长期面临的挑战,其中,缺乏跨尺度、高灵敏、原位表征的技术手段是制约其发展的关键问题。
针对上述问题,该研究提出了集纳米蛋白冠的原位表征和代谢分析方法、蛋白质组学、分子模拟计算在内三位一体的研究策略。研究人员基于同步辐射大科学装置与高分辨活体荧光成像,发展出跨尺度的原位化学测量方法,通过集成多种同步辐射先进分析技术(同步辐射微束X射线荧光、X射线近边吸收结构谱学、软X射线透射成像nanoCT等),建立了纳米材料在生命体内的代谢过程与化学形态的高灵敏、高分辨原位表征方法,实现了单细胞水平的纳米材料的空间定位,阐明了体内纳米材料的氧化还原、降解、代谢及生物化学转化行为。该研究综合运用先进光源的原位表征技术、“纳米蛋白冠”的互作规律研究、高性能理论计算的分子机制解析,并行实时交互多方数据链条,编织构造能够揭示纳米材料在生命体内的代谢全过程与化学形态的信息网。
以二硫化钼MoS2为研究对象,研究人员通过上述建立的分析方法,研究了纳米-蛋白质、纳米-血液、纳米-肝脏和纳米-脾脏等相互作用过程,揭示了材料表面的“纳米蛋白冠”组分载脂蛋白E(ApoE)主要介导MoS2在肝脏Kupffer细胞和脾脏红髓巨噬细胞中的富集;MoS2纳米材料在肝脏和脾脏中发生化学与生物转化,降解生成钼酸根离子,进而在肝脏进入钼酶中钼辅因子的生物合成,增加两种主要的钼黄素酶(醛氧化酶和黄嘌呤氧化还原酶)的活性。该研究首次系统地阐明了纳米蛋白冠介导的“纳米材料体内转运-生物转化-生物利用”这一“体内命运的全过程”,这为深入理解纳米-生物界面调控纳米材料体内复杂的化学生物学效应和机制提供了新认识;首次证实了含必需微量元素的纳米材料在体内可被生物利用的过程与机制。
随着学界在MoS2等二维过渡金属硫化物研究方面的进展逐渐深入,其在生物医学领域(如药物递送、肿瘤诊疗、生物成像和生物传感应用)显示出优越的性能。因此,这些纳米材料的体内应用需特别关注其在体内的生物利用度及其对药效的影响,这是纳米材料生物医学应用的新发现和新思考。
近年来,陈春英课题组基于同步辐射等大科学装置,建立与发展了针对复杂生物体系纳米材料的分析方法,这些方法具有高灵敏、高分辨、元素特异、原位等优点,被应用于定量解析纳米-生物界面大分子(蛋白质、磷脂)相互作用、定性表征纳米材料在生物体内的化学行为(Nature Nanotechnol, 2019, 14: 639; Acc Chem Res, 2019, 52: 1507; JACS, 2021, 143: 1846; JACS, 2013, 135: 17359等)。这些先进方法为纳米生物效应与纳米医学研究提供了关键和前沿的分析手段,有利于推动纳米生物医学的发展。
国家纳米中心博士毕业生曹明晶、副研究员蔡绒、博士毕业生郭梦雨和中科院高能物理研究所研究员赵丽娜为论文的共同第一作者,陈春英为论文通讯作者。研究工作得到国家重点研发计划、国家自然科学基金、中科院战略性先导科技专项(B类)和上海、北京和合肥光源等的支持。
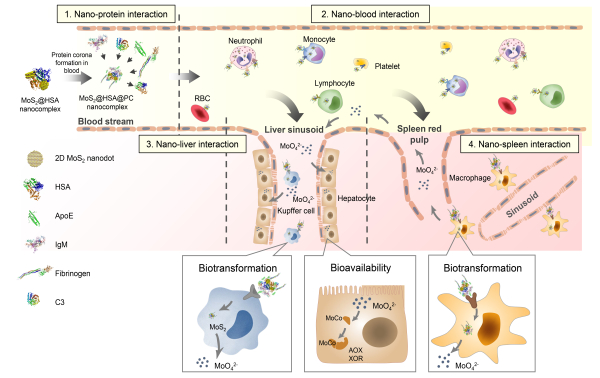
纳米蛋白冠介导的纳米材料“体内转运-生物转化-生物利用全过程”
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。