 1403
2021-01-14
1403
2021-01-14
近日,中国科学院大连化学物理研究所研究员王方军团队在蛋白质复合物形成和干预机制分析新方法研究方面取得进展,通过溶液状态蛋白质赖氨酸两步稳定同位素标记和定量蛋白质组学分析,实现对蛋白—蛋白识别关键位点区域的精确探测,并可评估小分子对蛋白质复合物的构象识别干预情况。
蛋白质的结构和相互作用决定了其生物学功能,目前对溶液状态蛋白—蛋白识别和结构动态变化研究仍然缺乏高灵敏度的分析方法。此前,研究团队发现蛋白质上赖氨酸的原位标记反应性与其所处微观结构中的氢键、静电相互作用强度密切相关;提出以蛋白质上所有赖氨酸位点为内源性反应探针,通过定量赖氨酸在蛋白—蛋白,蛋白—小分子结合前后的标记反应性变化,精确探测蛋白质识别过程中的关键区域。
为进一步提高赖氨酸反应性定量分析的通量和灵敏度,该团队进一步发展了溶液状态蛋白质“活性—变性”赖氨酸两步稳定同位素标记定量策略(TILLRP),系统研究了重组SARS-CoV-2 S1蛋白质和人体ACE2受体之间的相互作用情况;发现S1蛋白质RBD Lys386-Lys462区域的赖氨酸位点在S1-ACE2复合物形成前后标记反应性发生了显著改变;提出可以利用该区域赖氨酸的标记反应性调控水平评估小分子活性物质对S1-ACE2识别的干预情况,可能有助于相关治疗药物分子的研发。
该研究结果发表在《化学科学》(Chemical Science)上。上述研究工作得到国家自然科学基金、大连化物所创新基金等项目的资助。
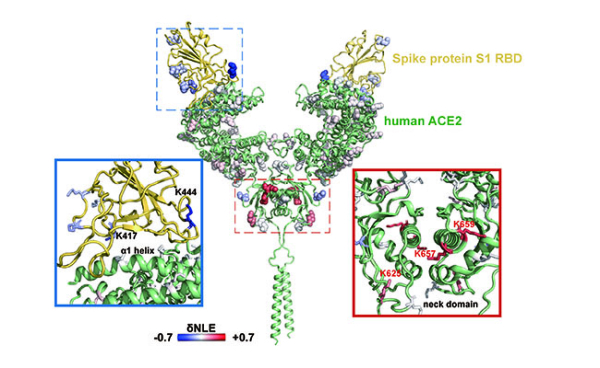
大连化物所提出蛋白质相互作用识别和干预机制分析新方法
上一篇: 合肥研究院等开发出自然光驱动催化剂
下一篇: 天津工生所体外合成功能性二糖研究取得进展
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。