 2774
2022-03-07
2774
2022-03-07
颗粒在线讯:研 究 背 景
H2O2是典型的环境有好型氧化剂,被广泛使用于环境修复、有机物转化、生命科学等多个领域。H2O2活化可以产生过氧化氢自由基(•O2H)、超氧自由基(•O2-)、羟基自由基(•OH)等多种活性氧物种。鉴于不同活性物种的氧化能力差异,H2O2定向转化成期望的活性氧是其高效、安全使用的关键。
由于H2O2同时具备电子受体和供体特性,它和单一金属位点之间氧化还原反应不宜控制,无法选择性生成特定活性氧物种,这也就是为何单一金属中心控制的H2O2活化通常被称为“半催化反应”。近年来,双位点催化已发展成为打破单一金属中心线性比例关系的新策略,在选择性活化小分子领域备受关注。因此,构建具有更灵活的几何和电子结构的双催化位点有望实现H2O2 选择性活化。
鉴于此,该工作以(001)面暴露的FeS2为载体材料,通过自组装策略将单原子层Cu5 纳米团簇稳固到 FeS2 表面去构筑Cu-Fe 双位点,实现了H2O2到•OH的高效选择性活化。
文 章 简 介
本文中,华中师范大学/上海交通大学张礼知教授课题组在国际知名期刊Angew. Chem. Int. Ed上发表题为“Atomic-Layered Cu5 Nanoclusters on FeS2 with Dual Catalytic Sites for Efficient and Selective H2O2 Activation”的研究论文。
作者结合理论和实验证明Cu原子可以在(001)面暴露的FeS2表面自组装成单原子层Cu5纳米团簇,而生成的Cu5纳米团簇可以在催化剂界面周边构建Cu-Fe双位点。不同于“半催化”的单一Cu或Fe催化位点与 H2O2 发生矛盾的氧化还原反应,Cu5/FeS2催化剂上的Cu-Fe双位点通过与H2O2形成桥连Cu-O-O-Fe络合物促进H2O2的吸附和自发解离,实现H2O2到•OH的持续稳定活化,从而解决H2O2活化无法精准调控产物的瓶颈问题。
得益于此,Cu5/FeS2-H2O2 体系可以在宽泛的 pH 范围内氧化降解多种有机污染物,并且克服传统Fenton技术面临的去污效率低、金属污泥累积和催化剂失活等多个问题。这项工作强调了双金属催化位点的概念,在表面分子水平上操纵H2O2选择性活化,同时也为开发高效的Fenton催化剂提供了一种新思路。
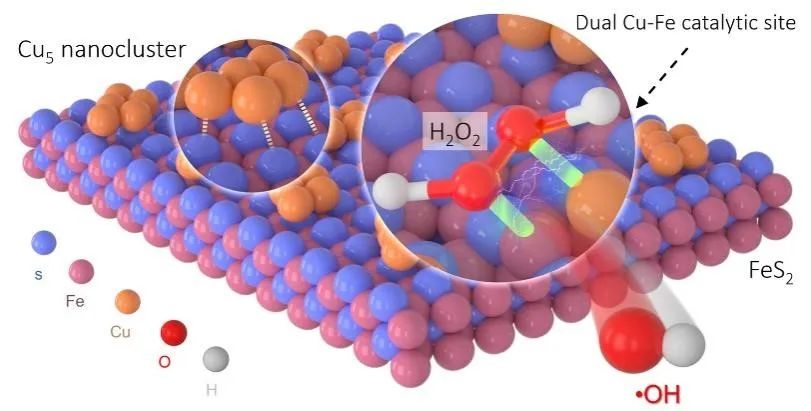
图1. Cu5/FeS2界面周边Cu-Fe双位点实现H2O2到•OH选择性活化示意图
本 文 要 点
要点一:(001)面暴露的FeS2表面自组装生成单原子层Cu5纳米团簇
本文通过湿化学法合成了Cu5/FeS2催化剂(图2)
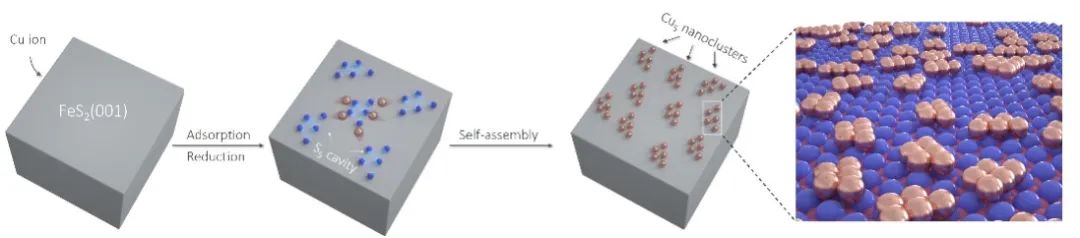
图2. 单原子层Cu5纳米团簇在FeS2(001)表面自组装示意图

图3. Cux/FeS2催化剂的表征。Cux/FeS2的 (a) TEM 和 (b) HRTEM 图,虚线等腰梯形表示 Cu5纳米团簇。(c) Cux/FeS2的 HAADF-STEM和对应的元素mapping图(绿色为 Fe,蓝色为 S,红色为 Cu)。(d) Cux/FeS2 的球差校正HAADF-STEM 图,虚线等腰梯形标注单原子层Cu5 纳米团簇所处位置。(e) 沿图3d 中的虚线测量的的线性图像强度轮廓。(f) Cux/FeS2 在 50 到 500 的 m/z 范围内的 TOF-SIMS 光谱,插图是 TOF-SIMS 测量示意图。(g) FeS2 和 Cu5/FeS2的Raman谱图,红色箭头表示拉曼峰的移动方向,灰色箭头表示 Cu-S 键。(h) Cu5/FeS2,Cu箔以及Cu2O的Cu K-edge X射线吸收近边结构(XANES)谱;(i)Cu5/FeS2和Cu箔的傅里叶变换K3权重Cu K-edge扩展X射线吸收精细结构(EXAFS)谱。
电镜表征证明合成的Cu5/FeS2催化剂很好地维持了FeS2载体的立方形貌,并且Cu5纳米团簇修饰在FeS2表面对载体晶格条纹有遮蔽影响(图3a和3b)。高角度环形暗场扫描透射电子显微镜(HAADF-STEM)获得了Cu5/FeS2催化剂表面清晰的Cu5纳米团簇原子像(图3c-3e)。TOF-SIMS表征证实Cu5纳米团簇是FeS2表面主要的Cu物种(图3f)。
Raman谱图显示Cu5纳米团簇修饰在FeS2表面后会在大约265 cm-1处出现一个与Cu-S键伸缩振动相关的新峰。Cu5/FeS2均一化的Cu K-edge XANES谱表明Cu5纳米团簇在FeS2表面处于部分氧化状态(图3h)。
最后通过EXAFS明晰了Cu5/FeS2界面的微观结构,在傅里叶变换的Cu5/FeS2的Cu k-edge EXAFS振荡曲线大约2.5 Å处明显有一个对应着Cu-Cu键的壳层信号,同时在1.7 Å位置处出现一个由第一壳层Cu-S键散射产生的特征信号峰(图3i)。EXAFS的拟合结果表明Cu5/FeS2界面上Cu-S和Cu-Cu配位数分别为1.0±0.1和2.8±0.6。结合以上表征结果,充分证明Cu5纳米团簇可以在FeS2表面自组装生成。
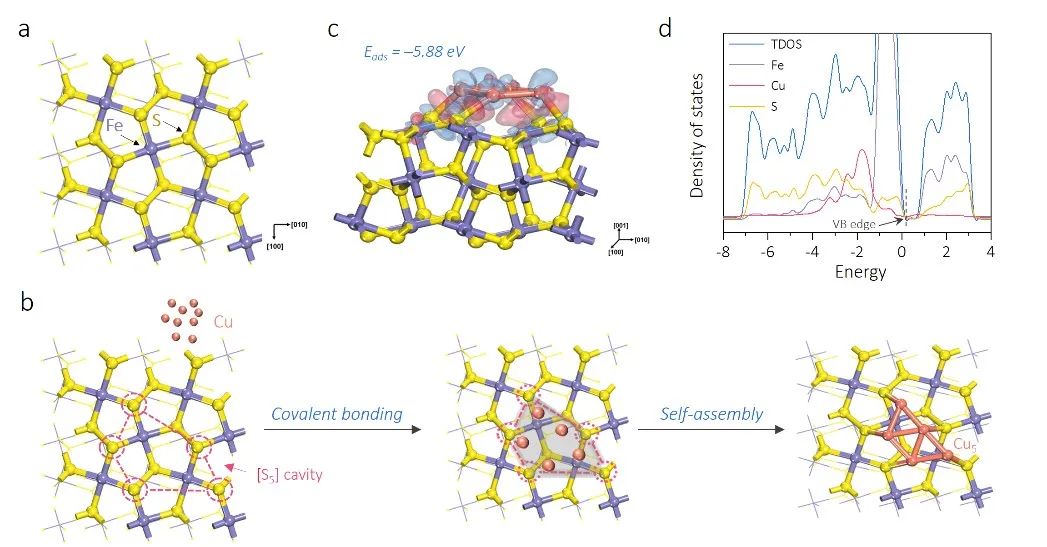
图4. Cu5纳米团簇在FeS2(001)表面的理论吸附。(a) 优化后的 FeS2(001) 表面俯视图。(b) FeS2(001)表面Cu吸附以及Cu5纳米团簇形成的示意图。(c)Cu5纳米团簇在FeS2表面的吸附构型以及对应的差分电荷图,其中蓝色半透明表示电荷密度的减少,红色半透明表示电荷的聚集;(d) Cu5/FeS2杂化结构的态密度。
理论计算结果表明,FeS2(001)面以配位不饱和的S原子暴露,其中五个临近的S原子可以组成内径大小在3.0~7.7 Å的[S5]捕获腔(图4a)。由于单个Cu原子可以自发吸附在FeS2表面,但是吸附放出的能量低于Cu颗粒的内聚能,因此吸附Cu原子有聚合成纳米团簇的倾向。
从单原子层Cu5纳米团簇的大小和[S5]捕获腔的尺寸来看,FeS2表面[S5]捕获腔是容纳Cu5纳米团簇的理想空间(图4b)。Cu5纳米团簇锚定在FeS2表面是一个自发放热的过程(5.88 eV),伴随着Cu5纳米团簇向FeS2界面转移0.12e净电荷以及Cu5/FeS2的价带(VB)边缘下S 2p和Cu 3d轨道之间强烈的杂化作用。这些结果共同证明Cu原子通过与S原子成键,在FeS2表面自组装成单原子层Cu5纳米团簇并稳定存在(图4c和4d)。
要点二:H2O2在Cu5/FeS2催化剂表面的理论吸附与活化
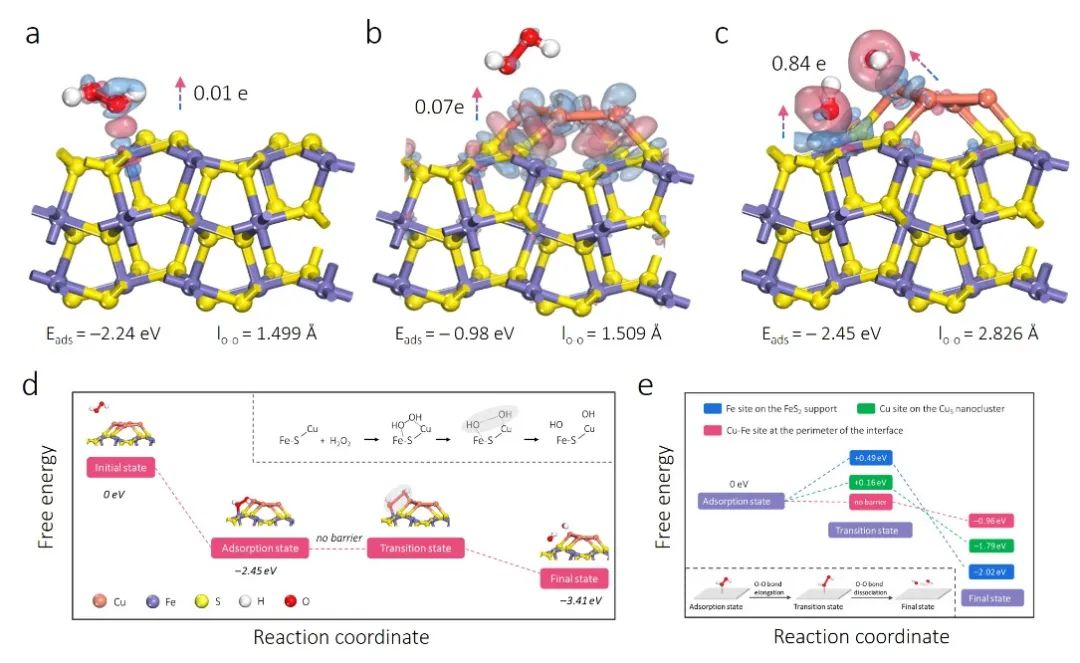
图5. H2O2在(a)FeS2(001)表面,(b) Cu5/FeS2表面Fe位点,(c) Cu5纳米团簇上Cu位点和 (d) Cu5/FeS2表面Cu-Fe双位点的吸附以及对应的差分电荷图,其中蓝色半透明表示电荷密度的减少,红色半透明表示电荷的聚集;(d) Cu-Fe双催化位点上H2O2分解为•OH的能量变化。(e) H2O2在不同催化位点活化为•OH的过渡态计算
在FeS2(001)表面,H2O2以 “end-on”模式化学吸附在五配位的Fe原子上(图5a)。在Cu5/FeS2表面, Fe原子和Cu5纳米团簇的Cu原子上只能将H2O2轻度活化(图5b)。
有意思的是,在Cu5/FeS2的界面周边区域,H2O2能够以 “side-on”模式共吸附在 Cu-Fe双位点上(图5c)。与单一的 Cu 或 Fe 位点不同,大量来自Cu-Fe 双位点的电子会立即向 H2O2 的两个吸附 O 原子上累积,此刻形成桥连 Cu-O-O-Fe结构的H2O2会在Cu5/FeS2表面自发解离成OH(图5d和5e)。因此,得益于Cu-Fe 双催化位点对 H2O2 的强解离作用, Cu5/FeS2理论上是一种很有前途的非均相 Fenton催化剂。
要点三:Cu5/FeS2催化剂选择性活化H2O2到•OH
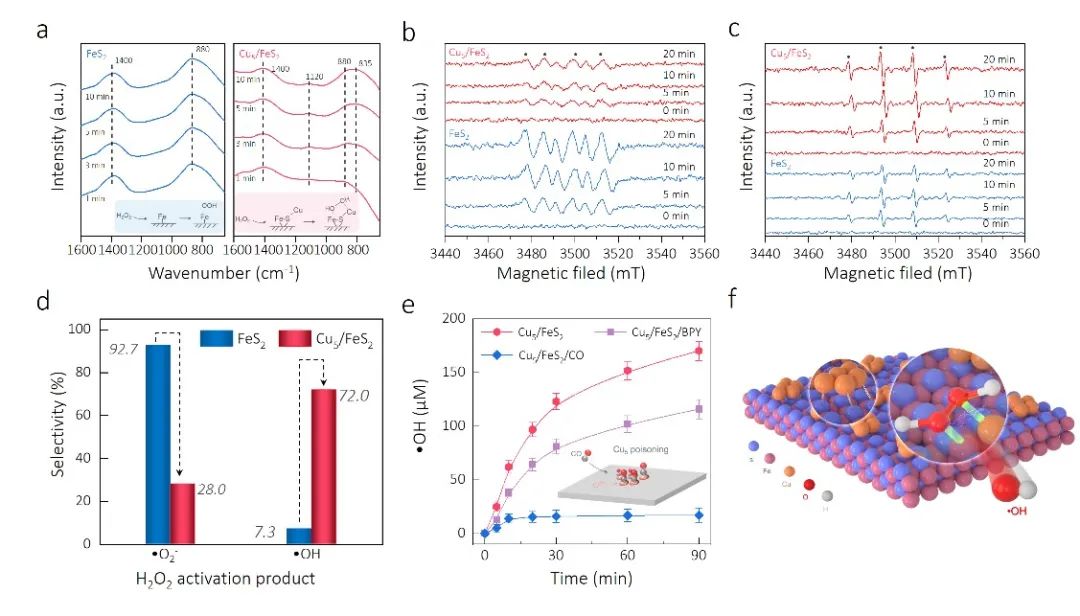
图6. (a) H2O2吸附在FeS2和Cu5/FeS2表面的in situ FTIR谱图。以DMPO为自旋捕获剂,FeS2-H2O2和Cu5/FeS2-H2O2体系中产生(b) •O2-和 (c) •OH的EPR谱。(d) FeS2和Cu5/FeS2活化H2O2生成活性氧物种的选择性。(e) 不同条件下Cu5/FeS2-H2O2体系中•OH的浓度变化曲线。(f) H2O2在Cu5/FeS2界面周边Cu-Fe双位点选择性活化示意图
In situ FTIR结果表明H2O2在FeS2表面吸附后会在1400 cm-1处出现由•O2−吸附在Fe位点(≡Fe-OOH)引起的伸缩振动峰;然而在Cu5/FeS2表面,•O2−的相关信号被抑制,相应地出现了归属于Cu-OO-Fe配合物中过氧键的弯曲和伸缩振动信号(图6a)。EPR技术很好地证实表面Cu-OO-Fe的形成能够促进H2O2向•OH的转化(图6b和6c)。
通过定量反应体系中•O2−和•OH的浓度,发现Cu5/FeS2催化剂将原本FeS2-H2O2体系中•O2−的生成选择性从92.7%降低到28.0%,而将•OH选择性从7.3%显著提高到72.0%(图6d)。最后通过不同环境下的对照实验证明Cu5/FeS2界面周边Cu-Fe双位点是促成H2O2到•OH选择性活化的关键(图6e和6f)。
要点四:高效降解有机污染物
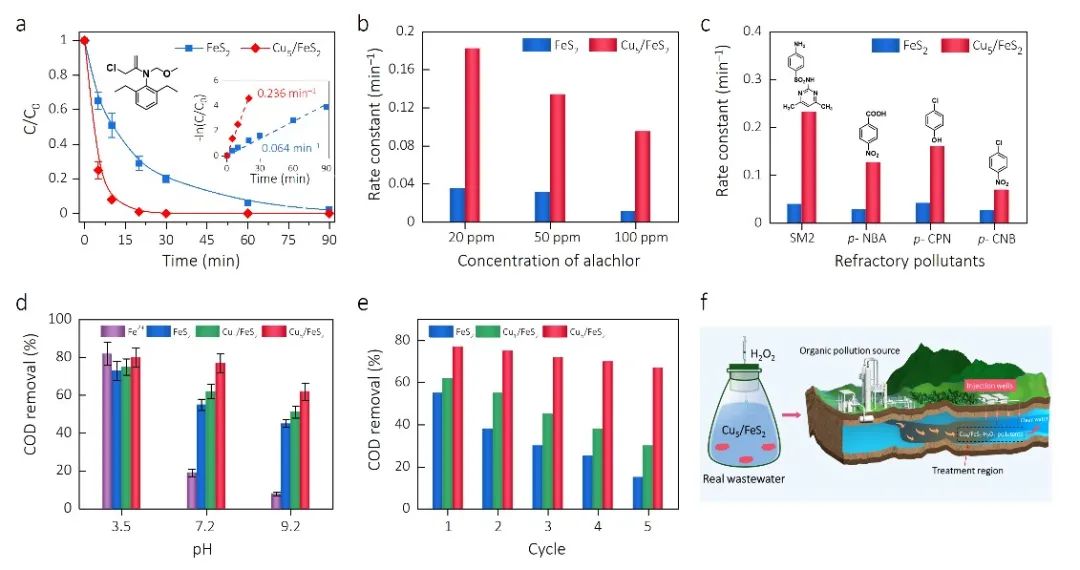
图 7. Cu5/FeS2作为芬顿试剂催化降解污染物的性能。(a) FeS2-H2O2和 Cu5/FeS2-H2O2体系中甲草胺的降解,插图为准一级动力学方程拟合的甲草胺去除曲线。(b)不同初始浓度下, FeS2 和 Cu5/FeS2去除甲草胺的速率常数。(c) FeS2 和 Cu5/FeS2去除其他难降解的有毒芳香污染物的速率常数。(d) pH 值对FeS2 和 Cu5/FeS2去除实际废水中 COD 的影响。Fe2+-H2O2 和 Cu1/FeS2-H2O2 体系也在相同条件下进行了评估以进行比较。(e) 不同催化剂循环去除COD图。(f) Cu5/FeS2作为Fenton催化剂进行工业废水处理以及现场土壤和地下水修复概念图
以难降解的甲草胺为目标底物,发现Cu5/FeS2-H2O2体系中甲草胺的降解速率(0.236 min-1)是FeS2-H2O2体系(0.046 min-1)的5倍以上。即便是与传统的铁基催化剂对比,Cu5/FeS2对甲草胺的催化降解效率仍然处在最佳水平。
得益于持续稳定地活化H2O2到•OH能力, Cu5/FeS2催化剂在不同的pH环境下(3.5-9.2)都能够有效净化由聚酯有机物组成的化工废水,使之达到国家合成树脂行业污染废水排放标准(GB31572-2015, 60 mg/L)。而FeS2-H2O2,Cu1/FeS2和均相Fe2+-H2O2体系只有在酸性条件下才能使工业废水达到安全排放的标准。
总 结 与 展 望
综上所述,(001)面暴露的FeS2表面可以自组装Cu原子形成单原子层Cu5纳米团簇。与 “半催化”的单一Cu或Fe催化位点不同,Cu5/FeS2催化剂的界面周边Cu-Fe双位点通过形成桥连Cu-O-O-Fe络合物促进H2O2的吸附和自发解离,从而精准控制H2O2到目标活性氧物种的转化。
得益于Cu5/FeS2催化剂原位稳定地活化H2O2到•OH,Cu5/FeS2-H2O2 体系能够在宽泛的 pH 范围内氧化降解多种有机污染物,并且解决传统Fenton体系存在的多个问题,如对难降解污染物的去除效率低、反应体系金属污泥堆积和催化剂失活等。这项工作强调了双金属催化位点的概念,在表面分子水平上操纵H2O2选择性活化,同时也为开发高效的Fenton催化剂提供了一种新的思路。
文 章 链 接
Atomic-Layered Cu5 Nanoclusters on FeS2 with Dual Catalytic Sites for Efficient and Selective H2O2 Activation
https://doi.org/10.1002/anie.202200670
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。