 2164
2022-03-08
2164
2022-03-08

颗粒在线讯:摘要
苏州大学李彦光教授团队对金属硫电池体系(包括Li-S、Na-S、K-S、Ca-S、Mg-S和Al-S)进行了系统介绍,分析和概括了金属硫电池在多硫化物穿梭、硫电极钝化失活和金属负极稳定性等方面的关键科学问题,并详细介绍了相应的解决策略。最后,基于锂硫电池的研究经验,对未来金属硫电池的发展进行了展望。
文章简介
硫电极具有资源丰富、价格低廉、理论比容量高等众多优点,在金属硫电池研究领域受到了广泛的关注。金属-硫电池可以选择不同的金属材料(Li、Na、K、Ca和Mg等)作为负极,这也赋予了各种金属硫电池在成本、循环寿命和能量密度上各有所长。虽然金属硫电池有很多优点,但实际商业化仍然面临着许多技术挑战。首先是可溶性多硫化物的溶解与穿梭导致了硫活性物质的损失与电池容量的衰减。其次,可溶性多硫化物也会与各种金属负极发生化学反应,导致金属负极的腐蚀和电解液的不断消耗。此外,金属离子不同价态和半径也造成了硫正极显著不同的反应路径和动力学速率。这些挑战在锂硫电池的相关研究中有的得到了一定的答案,而有些仍有待解决。金属硫电池体系因为具有相同的硫正极而具有很多共性之处,它们也因为不同金属负极之间的差异而具有很多不同点。梳理锂硫电池和其他金属硫电池之间的关联和差异,对于拓宽我们对锂硫电池的理解、促进其它金属硫电池的发展有着重要启发意义。
基于此目的,苏州大学李彦光教授团队系统地介绍了各种金属硫电池(包括Li-S、Na-S、K-S、Ca-S、Mg-S和Al-S)体系的优缺点和电化学反应机制,从多硫化物穿梭、硫电极钝化失活和金属负极稳定性等方面对金属硫电池的关键科学问题进行了分析和概括,同时详细介绍了相应的解决策略。最后,作者基于锂硫电池的研究经验,从硫正极的合理设计、反应机理的认识、提高金属负极稳定性和实用化金属硫电池设计等方面对未来金属硫电池的发展进行了展望。
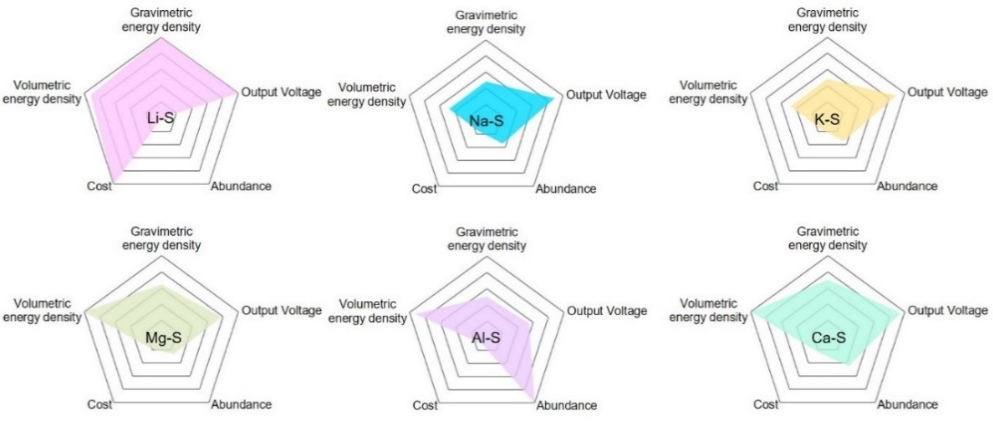
图1. 各种金属‒硫(Li-S、Na-S、K-S、Mg-S、Al-S和 Ca-S)电池的质量能量密度、体积能量密度、工作电压、金属储量丰度和价格的对比雷达图。
1. 硫电极的电化学反应机理
金属硫电池在放电过程中是一个多电子多步转化反应,依据反应路径I到Ⅵ形成一系列的多硫化物中间物(图2)。其整个16个电子的电化学反应过程一方面为金属电池提供了高的比容量,另一方面,由于大量中间产物的产生造成了许多难以解决的技术问题,如多硫化物的穿梭与溶解、硫电极非活性硫的积累、金属电极的钝化等。
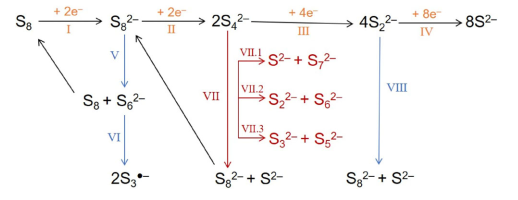
图2. 硫正极中可能发生的电化学反应与化学反应路径。
与锂硫电池相似,其它金属硫电池也会经历了一个多步固-液-固转换反应过程(图3)。一般来说,在高放电平台(区域I和II)的电化学反应对应硫还原成高阶多硫化物(Sn²⁻,n≥4),而随后高阶多硫化物还原成低阶多硫化物(Sn²⁻,n<4)则发生在低放电平台(区域III和Ⅳ)。由于各种形式的多硫化物在放电平台区域II和III处会在电解液中共存,因此电化学反应相对来说更加复杂。相比之下,放电区域IV通常被认为是不溶性低阶多硫化物之间的固-固转化反应。
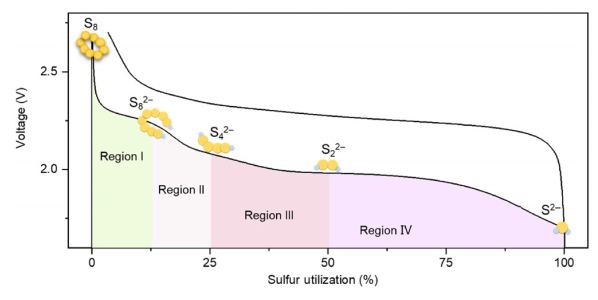
图3. 典型的金属硫电池充放电曲线和相应相变。
尽管金属硫电池有许多相似之处,但由于不同金属离子的差异,金属硫电池在反应路径上却大相径庭。已经有研究表明电解液Donor Number(简称DN)值会影响多硫化物中间产物的稳定性,从而导致锂硫电池中硫的电化学反应路径不同。类似地,电解液中不同的金属离子也会影响多硫化物可溶中间产物的稳定性,从而导致金属硫电池不同的反应路径。比如:研究发现具有较高平均电荷密度的S₄²⁻和S₃²⁻在含有较大阳离子(如K⁺和Ru⁺)的电解液中比含有较小阳离子(如Mg²⁺和Al³⁺)的电解液中更加稳定,从而使电化学转化反应朝着形成更加稳定的反应产物方向进行。这些研究发现也进一步证实了各种金属硫电池不同的反应路径。
此外,不同金属阳离子也影响着不可溶多硫化物的稳定性。在锂硫电池中,人们普遍认为Li₂S是最稳定的放电产物,而对Li₂S₂存在与否有一些争议,因为Li₂S₂是一种亚稳态相,可以自发地分解成Li₂S。相比之下,钾硫电池中放电产物K₂S₃的热力学稳定性(ΔGf⁰=528 kJ mol)在理论上高于K₂S(ΔGf⁰=410 kJ),这表明从K₂S₃到K₂S的还原比较困难,也证明了为什么在很多研究中K₂S₃经常被观察到是K-S电池唯一的最终放电产物。在Na-S电池中也观察到类似的结果,有研究检测到Na₂S₂(而不是Na₂S)是唯一的放电产物。相比之下,大多数研究表明CaS和Al₂S₃是Ca-S和Mg-S电池的放电产物。
2. 金属硫电池面临的挑战
作者总结了目前各种金属硫电池面临的关键挑战。主要从以下四个方面讨论和比较各种金属硫电池之间的相互关系和差异。(1) 多硫化物穿梭、(2) 硫正极失活、以及(3)金属负极钝化。
2.1. 多硫化物穿梭
与可溶多硫化锂(LiPS)相比,部分多硫化钠(NaPS)和多硫化钾(KPS)中间产物更容易溶于常用的醚基电解质。因此Na-S和K-S电池中的多硫化物穿梭和自放电行为更加严重。在具有多价金属阳极(如Mg、Ca和Al)的金属硫电池中,也会涉及到多硫化物的溶解和穿梭,但穿梭效应不像碱金属硫电池那样显著。其主要原因是多价金属多硫化物(如CaSₓ、MgSₓ和AlSₓ)在常用的醚基电解液中的溶解度远远低于LiPS、NaPS和KPS。此外,镁硫、钙硫和铝硫电池的循环不会出现无尽的充电现象。通过合理设计硫骨架、隔膜修饰、电解液调控、使用阻挡层和催化剂能够有效避免多硫化物的穿梭(图4)。
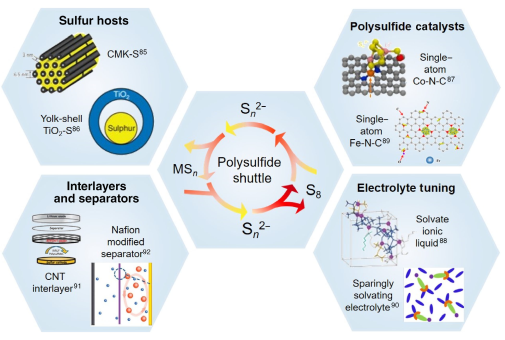
图4. 抑制金属硫电池多硫化物穿梭的一般性策略。如:硫骨架的合理设计、使用阻挡层和隔膜修饰、使用多硫化物催化剂和电解液调控。
2.2 硫正极失活
除了多硫化物溶解和穿梭造成的容量衰减外,在长时间电池循环中,越来越多的非活性物质积累导致的硫正极钝化也是造成容量下降的重要原因(图5)。在整个电池循环过程中,积累的非活性硫很难被重新利用,并作为惰性产物积累在硫正极中。这些积累的惰性产物的氧化动力学非常缓慢,需要额外的过电势来活化:例如惰性Li₂S的活化电位高达~3.7 V,多价金属硫化物(如MgS₂、CaS₂和Al₂S₃)需要的氧化过电位更高。通过使用电解液添加剂和氧化还原媒介小分子来重新活化积累的惰性放电产物是两条有效的解决问题途径(图5)。
2.3 金属负极钝化
金属锂和多硫化物之间的副反应会在锂表面形成离子绝缘的Li₂S钝化层,随着电池反复循环在锂表面积累到一定厚度,不仅造成严重的活性硫损失,而且还会阻碍Li⁺离子的扩散。此外,形成的钝化层在后续充电过程中很难去除,最终导致界面电阻增加和电池过早失效。金属Na、K和Ca负极比Li更加活泼,因此钝化问题更加严重。由于Mg(-2.37 V vs. SHE)和Al(-1.66V vs. SHE)标准电极电位相对于锂高很多,因此它们与可溶多硫化物的反应活性低了很多。但是在镁和铝表面形成的硫化物钝化层相对于Li₂S具有更低的离子传导能力,从而导致Mg-S和Al-S电池的循环稳定性更差。因此,目前相当一部分研究聚焦在探索新型电解液构建“无钝化”多价金属负极和寻找具有更高离子传导特性的人工SEI来修饰多价金属负极(图5)。
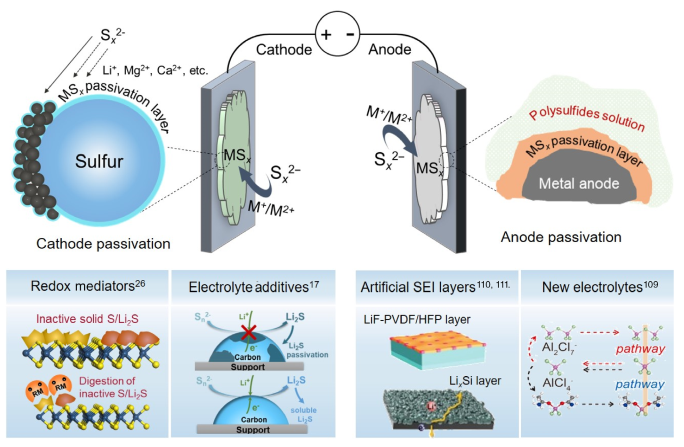
图5. 解决金属硫电池硫正极和金属负极失活钝化的一般性策略。包括:使用电解液添加剂、氧化还原媒介小分子来活化钝化层,以及使用人工SEI层和新的电解液设计来避免电极钝化失活。
3. 总结与展望
在文末,作者立足于锂硫电池与其它金属硫电池的共性和差异,总结了不同金属硫电池在电化学反应机理和性能衰退机制上的差异,基于锂硫电池的研究经验,从硫电极的合理设计、反应机理的认识、金属负极保护和实用化金属硫电池设计等方面进行了展望,希望能启发并指导金属硫电池的进一步发展。
论文信息
Room-temperature metal–sulfur batteries: What can we learn from lithium–sulfur?
Hualin Ye, Yanguang Li*
DOI: 10.1002/inf2.12291
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。