 2321
2022-07-25
2321
2022-07-25
颗粒在线讯:聚醚醚酮 (PEEK) 作为一种流行的骨科植入物,通常被制造成分级多孔结构以提高成骨活性。然而,由于过高的加工温度和不可控的繁琐改性路线,应用受到限制。为此,来自中国科学院长春应用化学研究所的栾世方教授和中国科学院大连化学物理研究所的周光远教授设计了一种具有羧基的无定形聚芳醚酮(PAEK-COOH),通过低温 3D 打印工艺可以制备分级可控的多孔支架。制备的PAEK-COOH支架呈现出从纳米级到微米级的可控多孔结构,其机械强度与骨小梁相当。体内和体外实验表明支架具有良好的骨整合效果。相关工作以“Low-Temperature Printed Hierarchically Porous Induced-Biomineralization Polyaryletherketone Scaffold for Bone Tissue Engineering”于近期发表在《Adv. Healthcare Mater.》上。
1. PAEK-COOH支架的设计方案
作者通过亲核取代缩聚反应合成了具有羧基的无定形聚芳醚酮(PAEK-COOH),调整溶剂的量即可获得不同浓度的生物墨水。通过低温沉积建模(LDM)即可一步制造出 PAEK-COOH 的分级多孔支架。特别的,PAEK-COOH支架的上羧基可以通过静电相互作用诱导HA的矿化从而加速体内骨的形成。
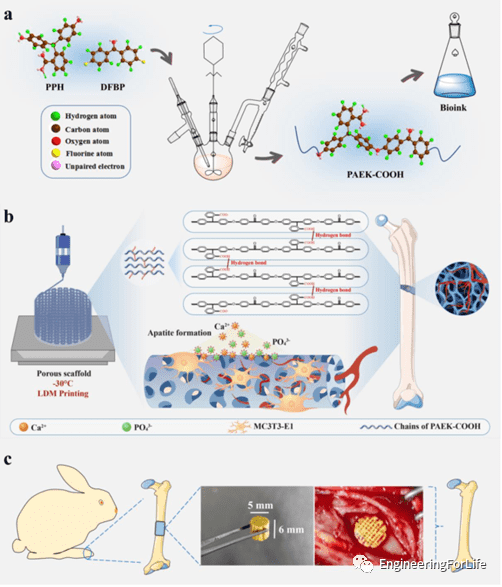
图1 分层多孔 PAEK-COOH 支架的制造和促骨形成的过程
2. PAEK-COOH支架的合成路线和可打印性验证
PAEK-COOH的合成路线如图2所示。用于 3D 打印的生物墨水应满足可打印性,包括连续流动性和机械稳定性。这些特性可以通过生物墨水的流变性能验证,因此作者测试了生物墨水的流变特性。流变结果表明,生物墨水的浓度可以通过PAEK-COOH 浓度进行改变实现剪切变稀行为,表明其具有很好的流动性。同时,不同浓度的PAEK-COOH 也具有不同的孔结构。基于流变行为和孔隙结构,发现 20% 的墨水浓度适合 3D 打印。
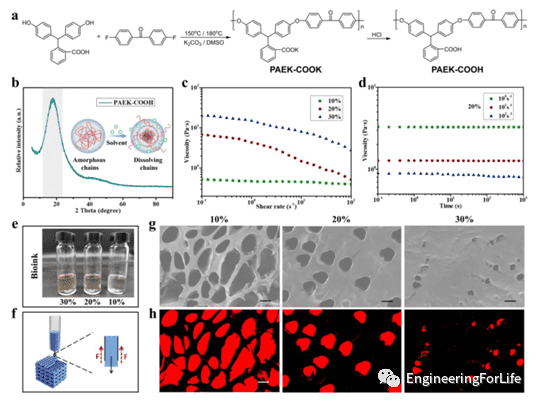
图2 PAEK-COOH 的合成和生物墨水的可印刷性
3. PAEK-COOH支架的层次结构
通过低温沉积建模(LDM)可以制备任何形状的设计多孔支架,并且可以在支架中找到两种孔径,一种是由 3D 建模软件设计的大孔径(数百微米),另一种是通过冷冻干燥过程形成的小孔径(数百纳米),如图3所示。微CT扫描可以观察到开放互连的孔隙结构,这有利于营养物质和活性因子运输到支架内部,促进细胞向内生长、血管化、和清除废料。这种支架从宏观到微观尺度的多级孔隙度类似于骨小梁层次。
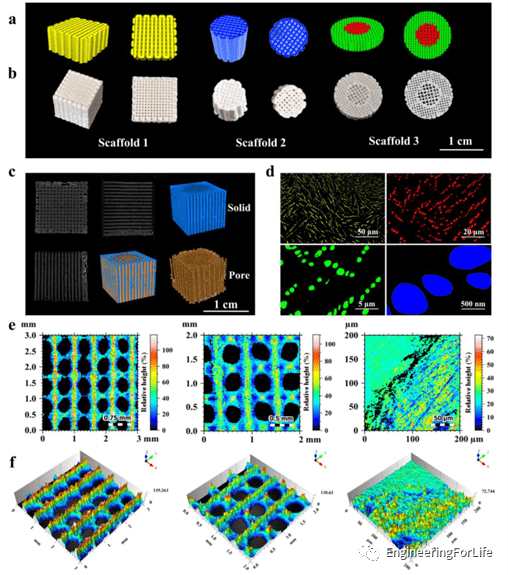
图3 从宏观到微观尺度的 3D 打印多孔支架结构
4. 两种打印技术制备的支架的不同属性
除低温沉积建模外,作者还进行了熔融沉积建模 (FDM)的支架设计对比,分别命名为LP和FP。SEM显示了LP和FP支架之间的差异,AFM显示了两种支架的表面微观结构。LP支架表面的羧基提供了更低的接触角,可以提供较大的比表面积供细胞粘附。此外,LP支架具有优异的抗压强度和模量能够更好的用作骨修复材料。
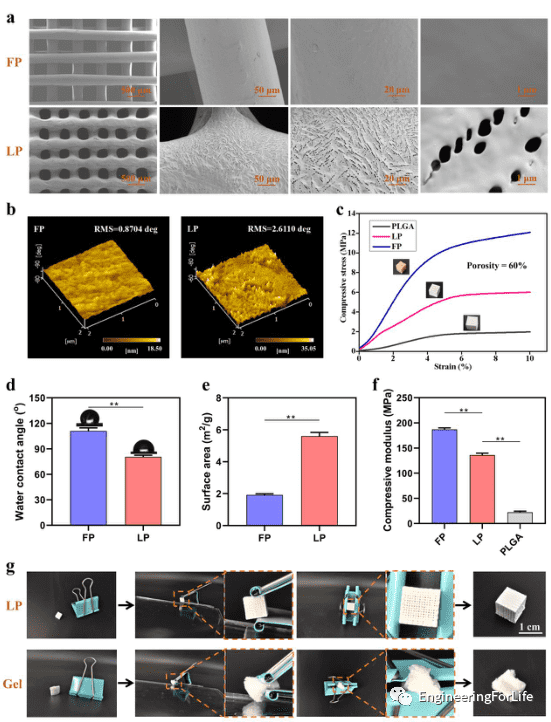
图4 LP和FP支架的结构和性能比较
5. 多纳米多孔表面促进细胞粘附
作者将 MC3T3-E1 细胞接种在不同的 3D 打印支架上,以评估不同表面对细胞行为的影响(图5)。两种支架上的细胞有着不同的状态,LP 纳米孔表面上的 MC3T3-E1 细胞就像登山者一样,借助形成的纳米级孔隙沿着支架纤维粘附和扩散。CCK-8表明两种支架均无细胞毒性,但具有纳米级孔隙的 LP 支架上的活细胞的覆盖的面积高于 FP,且LP 支架对细胞增殖有着更积极的影响。
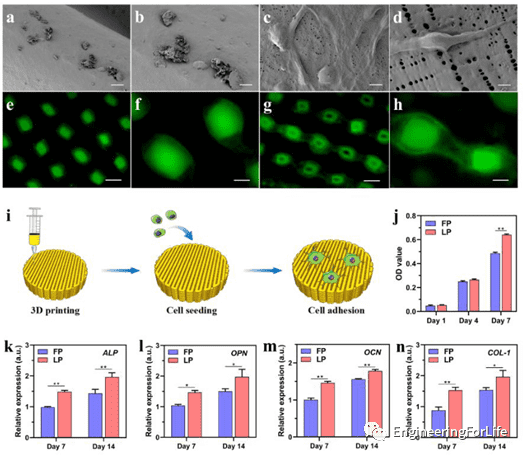
图5 纳米多孔表面的LP支架可促进细胞粘附
6. LP诱导的羟基磷灰石矿化
此部分主要探究了位于 PAEK-COOH 侧链中的羧基对 HA 矿化的影响。将两种支架浸泡在模拟体液 (SBF) 中后,使用 X 射线光电子能谱 (XPS) 分析不同支架上的元素。研究结果表明,LP 支架上富集的羧基促进了 SBF 中 HA 晶体的成核。之后利用SEM-EDS检查HA沉积,可以发现LP支架表面形成了一层完整且均匀的HA晶体涂层。
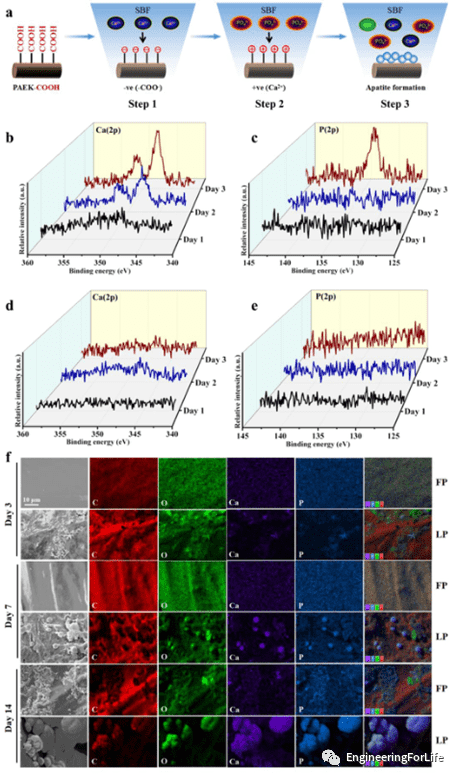
图6 使用MiH表皮电极用于脑电记录
7. 支架在体内的骨诱导能力
为了验证支架的骨诱导能力。作者将两种支架置于骨缺损部位,分别收集和处理不同时间点的Micro-CT图、组织学分析和生物力学测试。Micro-CT表明LP组中新形成的骨组织(红色)比FP组更占优势,并且在LP支架周围明显观察到致密的骨组织。组织学分析表明,LP组4周后新骨组织开始在支架表面生长,8周后在支架周围形成大量新骨组织。相反,FP组的骨缺损区域是散在的局部未成熟编织骨。LP组的新骨面积明显高于FP组,因此,LP支架因其优异的成骨诱导能力,可有效促进骨再生,在缺损区形成新骨组织更好的骨连接。
生物力学测试的结果显示骨组织和两个种植体之间的结合强度显着不同。LP组表现出更高的推出力 (132 N),从而意味着植入的支架和骨组织之间的机械互锁水平更高,这是由于多孔表面比光滑表面具有更高的粘合强度。
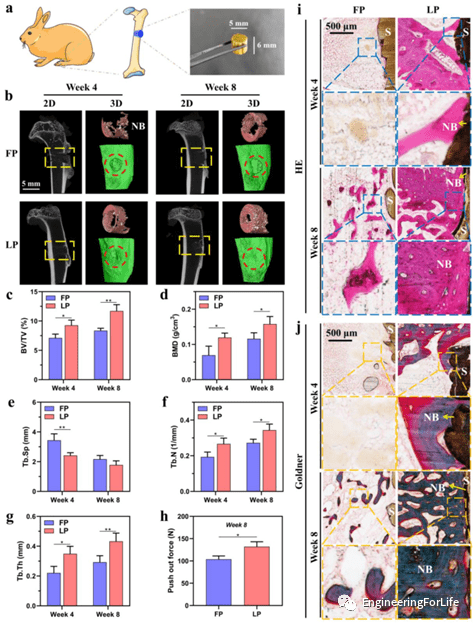
图7 体内骨再生分析
综上,本文利用低温3D打印工艺成功制造了一种用于骨修复的分级多孔 PAEK-COOH支架。支架具有从纳米级到微米级分级可控的微结构,机械强度满足骨小梁的承载要求。纳米多孔表面可以促进细胞粘附、扩散、分化,提高成骨能力。由于带电的羧基与体液中的离子之间的静电吸引相互作用,支架有利于HA的矿化沉积。植入的LP支架呈现出更丰富的新形成的骨组织,以及更高的骨矿化度,表明LP支架在体内具有更好的骨整合效果。同时作者表明,骨形成是一个复杂的过程,目前只考虑细胞行为和HA矿化的影响,而没有讨论其他因素,如免疫调节和血管生成潜力。此外,LP 支架可以修复的骨缺损的具体大小应在未来的研究中确定,但PAEK-COOH支架的设计理念和方法仍具有显著的优势。
文章来源:https://onlinelibrary.wiley.com/doi/abs/10.1002/adhm.202200977
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。