 1202
2021-01-12
1202
2021-01-12
近期,中国科学院生物物理研究所核酸生物学重点实验室研究员王江云与华中科技大学教授钟芳锐、吴钰周课题组合作,在JACS上,发表了题为Biocatalytic Cross-Coupling of Aryl Halides with a Genetically Engineered Photosensitizer Artificial Dehalogenase的研究成果。该研究报道了基于该课题组前期设计的一种可以基因编码的光敏蛋白质,进一步实现了光敏蛋白质吸收光能驱动卤代芳烃羟化脱卤反应的功能。
苯酚类结构普遍存在于药物、农药、材料和天然产物中,此前已报道过多种不同的策略合成此类结构,其中具有吸引力的方法是卤代芳烃直接羟基化,学界已报道了钯、铜等金属作为催化剂,强碱作为羟基源,对卤代芳烃直接进行羟基化。水作为一种绿色环保的溶剂,具有较大潜力作为羟基来源,目前虽已报道过以水作为羟基来源的卤代芳烃羟基化研究,但该领域仍存在开发价值,尤其是发展与酶催化水相体系相结合的体系。
王江云课题组前期研究发现,通过使用基因密码子扩展技术可将非天然氨基酸插入荧光蛋白(PSP),从而改造发色团生成具有高还原活性的物种,进一步在蛋白表面特定位置引入三联吡啶镍配合物,可驱动二氧化碳光还原(Nat. Chem.,2018;Acc. Chem. Res.,2019),在这些工作中,PSP蛋白表现出优异的光化学性质。基于此,王江云课题组与钟芳锐、吴钰周课题组合作设计,对引入PSP-NiII(bpy)人工光敏金属蛋白作为催化剂进行酚类物质的合成进行探索,期望将PSP-NiII(bpy)人工光敏金属蛋白进一步应用于光敏蛋白-金属协同催化小分子转化体系。
研究人员将对溴苯甲醛作为底物分子,在水相体系中探究了此光敏蛋白催化芳基卤化物脱卤与水进行交叉偶联构建酚类物质的活性,一系列条件优化后发现,PSP-NiII(bpy)可实现温和条件下卤代芳烃与水的交叉偶联构建酚类。进一步底物扩展实验表明,反应体系对不同取代的底物分子均以优异的产率得到相应苯酚类产物,同时也可进一步用于卤代芳烃脱卤构建C-N键。瞬态光谱实验表明,在任何条件下,均未观察到PSP自由基信号,因此,反应过程中可能没有产生PSP自由基,DIPEA仅作为碱促进产物的形成,PSP光敏蛋白吸收光能后通过能量转移促进激发态NiII复合物的形成,随后通过还原消除及氧化加成循环,实现酚类产物的合成。通过在PSP蛋白表面不同位点引入Cys突变体,进一步探究其发色团与镍催化中心之间距离对反应活性的影响,实验结果表明,当两者之间距离太大或太小均对反应活性存在较大影响,两者之间存在最适反应距离。
研究人员开发出一种温和条件下光敏金属酶催化交叉偶联反应的策略。这种人工光敏酶可有效整合PSP蛋白及NiII(bpy)配合物;可通过精确调控两者之间的距离,提高反应催化效率,其可将芳基卤化物高效转化为苯酚类物质,同时对形成高价值C-N键也具有潜力。
该研究由生物物理所和华中科技大学合作完成。王江云、生物物理所研究员刘晓红和钟芳锐、吴钰周为论文的共同通讯作者,华中科技大学和生物物理所联合培养研究生付雨、生物物理所研究生黄健为论文的共同第一作者。研究工作得到科学技术部、国家自然科学基金委和中科院的支持,获得生物物理所蛋白质科研平台的帮助。
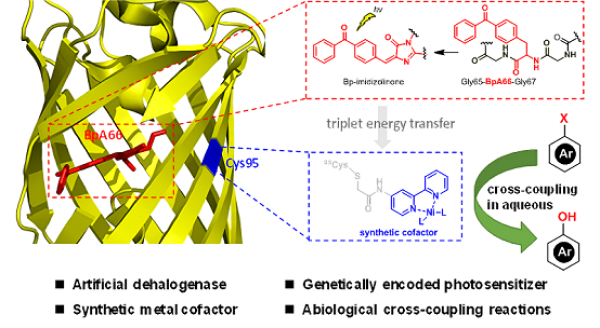
光驱动还原脱卤酶的设计
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。