 1418
2020-08-21
1418
2020-08-21
近年来,光脱保护基团(Photoremovable Protecting Groups,PPGs)在化学生物学和有机合成研究领域得到越来越广泛的应用。利用PPG与生物活性小分子共价键结合,可使小分子无法与其靶向的生物大分子(如蛋白质)结合而失去其活性。在光照下,激发态的PPGs与小分子间的共价键断裂,从而释放出具有生物活性的小分子。目前用于被保护的化学基团大多局限于羧基根等常见离去基团,不含这些基团的活性分子难以利用光控释放策略进行研究,特别是吡啶类化合物,它们作为芳香性杂环化合物,大多数具有生物活性,吡啶结构也广泛存在于药物分子中(如抗癌药Nilotinib)。然而,在水溶液中光控释放吡啶具有较大的挑战性。
近期,中国科学院化学研究所分子纳米结构与纳米技术院重点实验室研究员方晓红课题组发展了通过抑制分子内电子转移在水溶液中光解N-烷基吡啶盐释放吡啶的新策略。以7-二乙胺基-4-甲基香豆素保护的吡啶为研究对象,该课题组利用溶剂效应和TD-DFT理论计算发现,因存在香豆素与吡啶盐的快速分子内光致电子转移(Photoinduce Electron Transfer),脱去吡啶保护基团的光解反应难以进行。利用香豆素单线态S1与三线态T1间的能量差,在保护基团香豆素的3位引入重原子溴或者碘,提高S1态隙间穿越至T1态的几率,可抑制分子内电子转移,使光解相应N-烷基吡啶盐的效率分别提高约400或700倍。
该光解反应策略具有较好的普适性,适用于大多数吡啶衍生物以及咪唑和噻唑,化学产率高,成功用于二十余种吡啶化合物的光控释放,光解效率与吡啶环上氮原子的亲核能力和吡啶环的电子云密度相关。此外,该光解反应亦可通过双光子激发来实现,以N-烷基吡啶盐为例,其在880 nm光照下的双光子光解吸收截面高达0.51 GM。该光解反应成功应用于活细胞内的活性分子释放。在光毒性较低的488 nm光照下,实现了含有吡啶结构的微管蛋白聚合抑制剂Indibulin在活细胞内的释放和对微管蛋白聚合抑制功能的调控。这是首次报道的通过高效光解有机PPG保护的N-烷基吡啶盐释放吡啶的方法,加深了对光脱保护基团物理化学过程分子机制的理解,为在活细胞体系开展基于吡啶结构的生物活性分子的化学调控、药物递送、超分辨成像等研究提供了新工具。
相关成果发表在《德国应用化学》上,论文第一作者为博士唐小军,通讯作者为方晓红。研究得到国家自然科学基金委支持。
论文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202005310
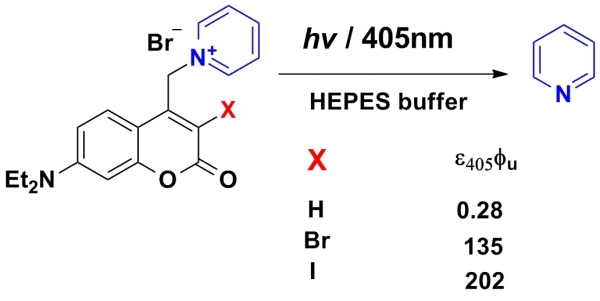
引入重原子提高N-烷基吡啶盐的光解反应效率
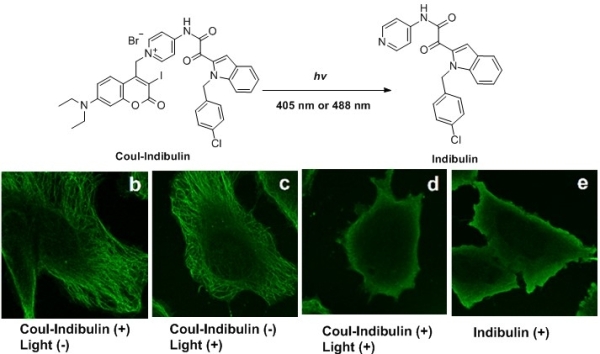
含有吡啶结构的微管蛋白聚合抑制剂Indibulin在活细胞内光解释放Indibulin,实现其调控功能
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。