 3751
2022-03-14
3751
2022-03-14
颗粒在线讯:哺乳动物微生物群落已经在活体内生活了数百万年,甚至与人类一起进化。它们可以感知人体内部或外部场景的变化,从而反映人类健康水平,甚至引发多种疾病。为了深入了解微生物群落以及准确控制基于细菌的治疗或诊断方法,在宿主体内精确地成像微生物位置是非常重要的。然而,现有的活体细菌定位成像方法主要基于光学报告基因、有机染料或纳米探针,对于深部组织来说,其成像效果会因低成像深度和高光散射组织而大大减弱。此外,大多数显像剂仅对一类特定细菌有效,即革兰氏阴性或革兰氏阳性细菌,这会不可避免地丢失其他细菌的信息。
舌头表面的细菌分布
目前,大多数显像剂通过使用抗生素、抗菌素、和酶激活纳米颗粒等靶向细菌细胞壁。然而,细菌细胞壁上信号分子的有效载荷比内吞进细菌胞内要少得多,导致成像灵敏度降低。另一方面,尽管基因编码细菌的报告分子存在于细胞内、中,但它们受宿主细菌的病理生理过程、基因表达谱和可视化生物化学的影响从而不能用于诊断细菌感染。除此之外,关于纳米材料通过内化进入细菌并同时用于成像和感染治疗的研究更是几乎未见报道。
细菌“吃掉”纳米材料
苏州大学何耀教授、王后禹副研究员等人提出了一种新型策略,可促进细菌摄取葡萄糖聚合物修饰的金纳米颗粒。激光照射后,这些颗粒聚集在细菌细胞中,产生增强的光声信号和抗菌活性,从而实现体内细菌的灵敏成像。在成像和治疗性能方面,与未聚集的对应物相比,聚集物的功效显著增强(例如,光声信号增强约15.2倍,抗菌率增强约3.0倍)。进一步地,作者还证明了该策略有助于在异种肿瘤移植和胃肠道的概念验证模型中对细菌进行成像。因此,研究认为这一工作为探测微生物种群的体内位置并对其进行治疗提供了一种简便有效的思路。相关工作以“Bacteria eat nanoprobes for aggregation-enhanced imaging and killing diverse microorganisms”为题发表在Nature Communications。

【文章要点】
一、纳米探针
纳米探针由四个模块组成,分别是金纳米颗粒(AuNPs)、葡萄糖聚合物(GP)、二嗪和光敏剂Ce6。作者首先通过希夫碱反应制备GP-共轭AuNPs(GP-AuNPs),其中GP的醛基 与AuNPs上的氨基反应形成席夫碱,然后被NaBH4还原形成稳定结构。接下来,通过GP AuNPs和Ce6之间的静电吸附作用可获得GP-AuNPs@Ce6。最后,作者利用NHS-二嗪分子修饰GP -AuNPs@Ce6表面最终获得纳米探针GP-dAuNPs@Ce6。实验显示,在405nm激光照射下,改性的二嗪类化合物可转化为卡宾片段,而卡宾片段之间容易形成共价键,从而形成聚集产物(图1)。
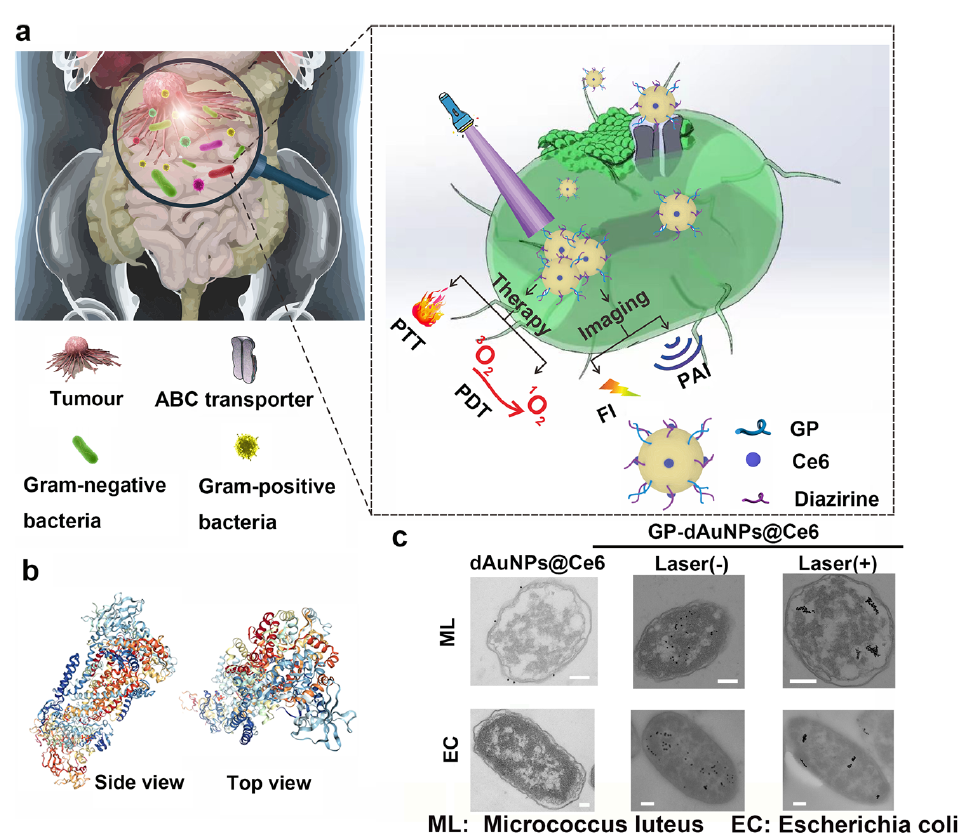
图1 GP-dAuNPs@Ce6的表征
二、细菌“吃掉”纳米探针
如图2所示,包括革兰氏阴性菌和革兰氏阳性菌在内的细菌能够通过细菌特异性ABC转运体途径主动吞咽其伪造的“食品”,即GP-dAuNPs@Ce6。根据研究解释,这主要是因为GP(例如聚[4-O-(α-D-吡喃葡糖基)-D-吡喃葡糖)作为细菌的主要“食物”(碳源),可以通过由外膜扩散孔蛋白、GP识别位点等五个亚单位组成的ABC转运体稳定地内化到细菌细胞中。高分辨率SEM和高角度环形暗场扫描TEM(HAADF-STEM)均证明了GP共轭的金纳米颗粒穿过了细菌细胞壁,而不是吸附在细菌细胞壁表面(图2)。定量实验发现,当GP-dAuNPs@Ce6的浓度为1mg/mL时,金黄色葡萄球菌SA和大肠杆菌EC的摄取效率可分别达到69.2%和69.7%。
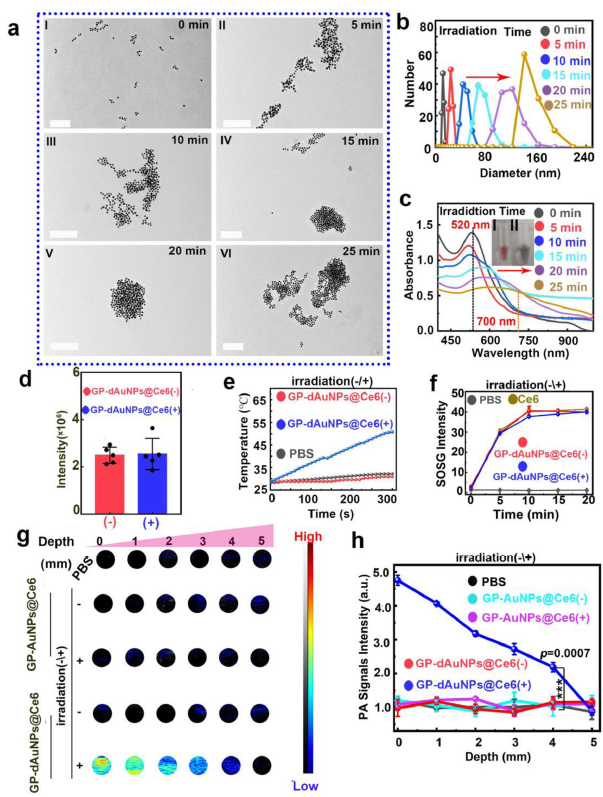
图2 细菌“吃掉”金纳米颗粒的策略设计
三、聚集增强的成像和治疗性能
由于二嗪分子的光活性交联性质,在405nm激光照射下,被细菌摄取内化的纳米探针可以彼此聚集,显示出显著增强的光声信号。在活体实验中,研究可在感染位点同时观察到细菌的光声成像和荧光成像,其检测限浓度可低至1.0 × 105 CFU的水平,比大多数光学成像造影剂低约两个数量级。而在肿瘤部位的成像中,含有细菌的肿瘤部位也可同时观察到荧光和光声信号。同时,接受405nm激光照射的感染部位和含有细菌的肿瘤部位的检测信号都比未接受405nm激光照射的部位强得多(光声信号增强在2倍以上)。同时,实验结果也证明了该策略可对肿瘤组织中的多种细菌进行聚集增强成像。利用所开发的策略,作者也成功地检测到肿瘤或肠道内细胞浓度约为1.0×107 CFU的多种细菌,如此高的灵敏度足以满足许多体内场景(图3)。此外,在辐照过程中,405 nm激光导致纳米探针聚集,660 nm激光则可以诱导Ce6产生单线态氧(光动力疗法效应),808 nm激光则触发聚集的AuNP产生热(光热疗法效应),从而使得纳米探针表现出超高的体内广谱抗菌效率,在短期治疗中杀菌效率可超过95.0% 。
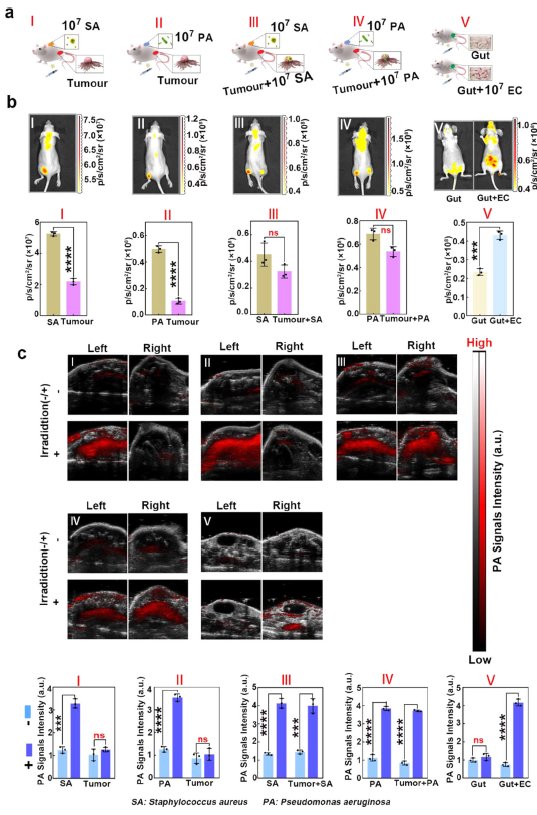
图3 细菌体内成像效果
结论:综上所述,作者成功提出设计了一种新型诊断和治疗策略,可通过细菌摄取纳米探针,来实现聚集增强成像并在体内杀死多种细菌。该纳米探针由GP、二嗪和Ce6修饰的AuNP制成,凭借细菌特异性ABC转运途径,纳米探针可以稳定、选择性地内化到革兰氏阴性和革兰氏阳性细菌细胞中,同时几乎不进入哺乳动物细胞。相比之下,大多数报道的纳米制剂对细菌细胞的特异性比哺乳动物细胞差,导致难以区分细菌感染和其他炎症症状。再加上具有良好的生物相容性,这种性能优异的策略在组织微生物研究以及诊断和治疗药物的开发方面具有良好的前景。
版权与免责声明:
(1) 凡本网注明"来源:颗粒在线"的所有作品,版权均属于颗粒在线,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已获本网授权的作品,应在授权范围内使用,并注明"来源:颗粒在线"。违反上述声明者,本网将追究相关法律责任。
(2)本网凡注明"来源:xxx(非颗粒在线)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
(3)如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。